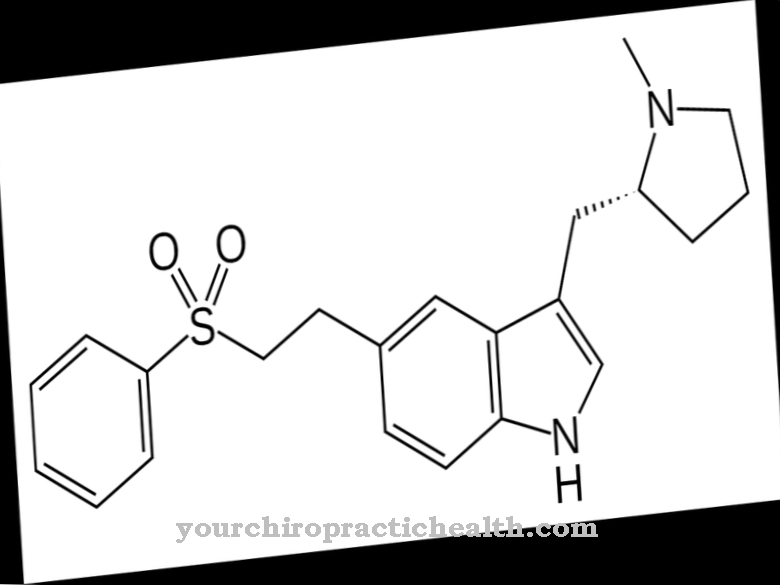
Rituximab es un fármaco de la clase de fármacos citostáticos. Es un anticuerpo monoclonal que se utiliza principalmente en el tratamiento de linfomas malignos.
¿Qué es rituximab?
El rituximab fue desarrollado por Lee Nadler en el Dana-Farber Cancer Institute en la década de 1990. Fue el primer anticuerpo aprobado en todo el mundo para el tratamiento del cáncer. En la UE, Roche vende Rituximab con el nombre comercial MabThera®.
El fármaco producido biotecnológicamente se utiliza principalmente en la UE para la inmunoterapia contra el cáncer. Pero también está aprobado para el tratamiento de enfermedades autoinmunes. Los efectos secundarios son bastante comunes cuando se toma rituximab. Más de la mitad de los pacientes con cáncer experimentan fiebre, erupciones cutáneas o dificultad para respirar. La sustancia es mejor tolerada por pacientes con artritis reumatoide. Los efectos secundarios graves como el síndrome de Stevens-Johnson o la necrólisis epidérmica tóxica son raros.
Efecto farmacológico
Rituximab es un anticuerpo monoclonal. La inmunoglobulina IgG kappa se dirige contra el antígeno de superficie CD20. Este antígeno de superficie se encuentra principalmente en la superficie de los linfocitos B. El CD20 se encuentra en casi todas las neoplasias de células B. Solo tiene sentido usar rituximab en enfermedades cancerosas si las células cancerosas tienen la molécula de superficie CD20. En estas células, rituximab se une a CD20. Esto crea un complejo que moviliza la propia respuesta inmunitaria del cuerpo.
La destrucción de las células que expresan se inicia mediante tres mecanismos de acción diferentes. Por un lado, se inicia la muerte celular programada (apoptosis) en las células afectadas. En el proceso, las células primero se desprenden del tejido. Se vuelven cada vez más eosinofílicos en color y se vuelven más pequeños. Se forman ampollas en la membrana celular. El núcleo celular también se vuelve cada vez más denso y pequeño. Al final de la apoptosis, queda un pequeño cuerpo de apoptosis, que es eliminado por fagocitosis. Con la muerte celular programada, no hay reacciones inflamatorias.
Además de la apoptosis, también se desarrolla lisis de células B dependiente del complemento. Los diversos factores del complemento reaccionan. El sistema del complemento es un sistema en cascada de proteínas plasmáticas. Al final de la cascada, estos desencadenan una respuesta de anticuerpos en la que las células afectadas son atacadas. A esto le sigue una reacción inflamatoria con eventual destrucción de las células.
El tercer mecanismo de acción se basa en la citotoxicidad celular dependiente de anticuerpos. Rituximab atrae macrófagos, granulocitos y células T asesinas naturales, que eliminan las células afectadas.
Aplicación y uso médico
El rituximab se usa principalmente para tratar el cáncer. El fármaco es parte de la terapia estándar para los linfomas no Hodgkin foliculares y malignos de bajo grado. Los linfomas no Hodgkin son todas enfermedades malignas del sistema linfático que no son la enfermedad de Hodgkin. Los linfomas se expresan como agrandamiento no doloroso de los ganglios linfáticos, cansancio, pérdida de peso, fiebre, sudores nocturnos o una mayor susceptibilidad a las infecciones.
En estos casos, el rituximab se suele combinar con quimioterapia convencional. El esquema CHOP se utiliza a menudo. Incluye los medicamentos ciclofosfamida, daunorrubicina, vincristina y prednisolona. Los estudios demuestran que la combinación del protocolo CHOP con rituximab tiene un efecto positivo sobre el pronóstico.
El rituximab también es uno de los fármacos más importantes que se utilizan para tratar el linfoma asociado a trasplantes. Estas son enfermedades malignas similares al linfoma que ocurren después de un trasplante de órganos o células madre.
El rituximab también se usa en combinación con el fármaco bendamustina para tratar la leucemia linfocítica crónica avanzada. Sin embargo, estudios más recientes indican que los resultados del tratamiento mejoran cuando rituximab se combina con ciclofosfamida y fludarabina.
Cuando fallan los fármacos estándar y el inhibidor de TNF-α inicial, el rituximab también se usa para tratar la artritis reumatoide. La artritis reumatoide es una inflamación crónica de las articulaciones, que también se conocía anteriormente como artritis reumatoide. Por lo general, las articulaciones de los dedos se ven afectadas. Para muchos pacientes, dos infusiones en dos semanas pueden proporcionar una buena mejoría de los síntomas durante un período de un año. Se recomienda un intervalo de tratamiento de seis meses. Más infusiones pueden mantener o mejorar el éxito del tratamiento.
Otra indicación para el uso de rituximab es la glomerulonefritis membranosa. La enfermedad inflamatoria crónica de los corpúsculos renales se basa en la formación de anticuerpos contra las proteínas de las células renales.
Puedes encontrar tu medicación aquí
➔ Medicamentos para fortalecer las defensas y el sistema inmunológicoRiesgos y efectos secundarios
En oncología, más del 50 por ciento de los pacientes desarrollan efectos adversos. Estos incluyen fiebre, dificultad para respirar, erupciones cutáneas y escalofríos. Los síntomas graves probablemente se deben a la descomposición masiva de las células cancerosas destruidas. Muchas citoquinas se liberan durante esta degradación. Las citocinas son proteínas que juegan un papel importante en las reacciones inmunológicas y los procesos inflamatorios.Por lo tanto, los síntomas que surgen durante la caries también se resumen bajo el término síndrome de liberación de citocinas. El síndrome ocurre principalmente en pacientes con una gran masa tumoral. Estos efectos secundarios suelen mejorar con el tratamiento.
Los pacientes individuales con cáncer pueden desarrollar leucoencefalopatía multifocal progresiva (LMP) durante el transcurso del tratamiento. El cerebro es atacado por el virus JC debido a una inmunodeficiencia. La infección viral oportunista siempre es fatal. La mayoría de los casos de leucoencefalopatía multifocal progresiva ocurren en pacientes con cáncer de los ganglios linfáticos y durante el tratamiento concomitante con fármacos citotóxicos inmunosupresores. También se conocen casos de LMP en pacientes con enfermedades autoinmunes.
Los efectos secundarios graves, como el síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica, ocurren en menos del 0,01 por ciento de los pacientes tratados.











.jpg)