Lisil oxidasa es una enzima del tejido conectivo que tiene funciones catalíticas y promueve la reticulación de colágeno y elastina. La enzima tiene un efecto estabilizador sobre el tejido conectivo al realizar una desaminación oxidativa y crear así las condiciones básicas para la reticulación. En Cutis laxa, la actividad de la lisil oxidasa se reduce.
¿Qué es la lisil oxidasa?
Existen diferentes enzimas en el cuerpo humano, todas las cuales tienen actividad catalítica. Las enzimas permiten reacciones en el cuerpo humano o las aceleran. La lisil oxidasa es una enzima que se encuentra en el tejido conectivo humano. También se llama proteína lisina 6 oxidasa y se encuentra principalmente en el espacio extracelular del tejido conectivo.
La actividad catalítica de la enzima en este caso se relaciona con la reticulación entre colágeno y elastina. La lisil oxidasa estabiliza las dos proteínas de forma mecánica y, por lo tanto, permite la conexión reactiva. La lisil oxidasa no solo se encuentra en el cuerpo humano. Otros vertebrados también están equipados con la enzima. Se considera que la lisil oxidasa es un estabilizador del tejido conectivo. Una deficiencia de la enzima conduce al cuadro clínico de cutis laxa, una debilidad severa y hereditaria del tejido conectivo.
Función, efecto y tareas
La lisil oxidasa asume tareas importantes en el espacio extracelular en la conexión cruzada entre moléculas de colágeno individuales. En el cuerpo humano, el colágeno juega un papel importante dentro de las proteínas, con aproximadamente el 30 por ciento de la masa total de proteínas.
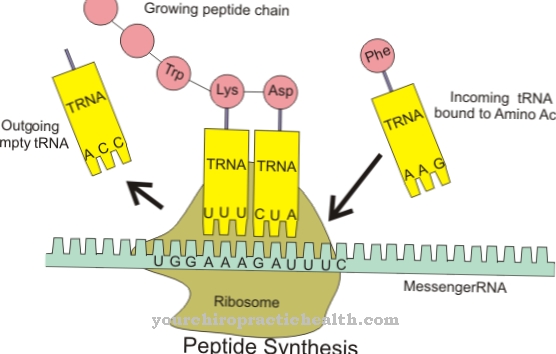
El colágeno es la proteína más común. Es una proteína estructural y de construcción que forma muchas partes del cuerpo, como tejido conectivo, huesos, dientes, cartílagos, tendones, ligamentos y piel. La lisil oxidasa apoya la unión del colágeno a los grupos carbonilo y, por tanto, contribuye a la estabilidad de los componentes corporales mencionados. Tiene actividad catalítica para la producción de grupos carbonilo que forman enlaces cruzados covalentes en colágenos en condensaciones aldólicas. Por tanto, la tarea catalítica de la lisil oxidasa es prepararse para la formación de fibrillas. La enzima crea todas las condiciones químicas necesarias para la formación.
Las fibrillas se consideran fibras de fibra. Corresponden a partes delgadas y fibrosas del cuerpo y se encuentran en las paredes de las células vegetales, en los músculos humanos y en el tejido conectivo. La tarea de la lisil oxidasa en este contexto es esencialmente la desaminación oxidativa de residuos de lisilo. En química, la desaminación es la separación química de los grupos amino como iones de amonio o amoniaco. La desaminación oxidativa divide los grupos amino del aminoácido L-glutamato del hidrógeno y los oxida a grupos imino con la transferencia de hidrógeno a NAD + o NADP +.
A esto le sigue la escisión hidrolítica de los grupos imino como iones amonio, que está asociada con la formación de α-cetoácido. La desaminación corresponde al primer paso en la degradación bioquímica de los aminoácidos, que en los mamíferos tiene lugar principalmente en el hígado. El ion amonio formado durante la desaminación se convierte en urea. Los procesos de desaminación de la lisil oxidasa dan lugar a grupos aldehído que, junto con los grupos amino individuales de otros residuos lisilo, dan lugar a las llamadas bases de Schiff y, por tanto, pueden formar las reticulaciones estabilizadoras en el colágeno.
Educación, ocurrencia, propiedades y valores óptimos
La lisil oxidasa en el ADN está codificada por el gen LOX, que en humanos se encuentra en el cromosoma 5 en el locus del gen q23.3 a q31.2. El producto génico no es la forma final de la enzima. El producto no es una lisil oxidasa acabada, sino una forma predecesora que, después de la traducción, tiene una masa molar de 47 kDa.
La glicosilación ocurre en el curso posterior. Durante este proceso, la masa molar de la última enzima aumenta a 50 kDa y la forma predecesora de lisil oxidasa se secreta en el espacio extracelular. Después de la secreción, la pre-pro-lisil oxidasa se procesa más. La sustancia se divide en el espacio extracelular. La proteína 1 es la encargada de dividirse en dos fragmentos, de esta forma, por un lado, se produce la lisil oxidasa de 32 kDa. Por otro lado, se crea una sustancia residual, que en este caso corresponde a un polipéptido.
Enfermedades y trastornos
Los defectos genéticos en la lisil oxidasa pueden causar el cuadro clínico de cutix laxe. Esta enfermedad también se llama dermatocalasia y se refiere a un grupo de debilidades del tejido conectivo que a menudo están relacionadas con la edad, que en la mayoría de los casos se observan con acumulación familiar.
La característica común de todos los fenómenos de dermatocalasis es la piel flácida e inelástica, que a menudo cuelga en grandes pliegues en varias partes del cuerpo. La mayoría de los afectados parecen mayores de lo que son debido a los cambios. Las enfermedades son causadas, entre otras cosas, por mutaciones genéticas. En este contexto, estamos hablando del síndrome de cutis laxa. La enfermedad puede existir en formas autosómica recesiva, autosómica dominante y cromosómica x. En muchos casos, el síndrome de cutis laxa se asocia con otras anomalías y, si los órganos están involucrados, por ejemplo, puede ser fatal.
ARCL1 corresponde a una cutis laxa del tipo 1 autosómico recesivo y se considera la forma más grave, que en determinadas circunstancias puede conducir a complicaciones potencialmente mortales. La forma ARCL1A está asociada con mutaciones en el gen FBLN5 en el locus 14q32.12. El tipo ARCL1B se asocia con mutaciones en el gen EFEMP2 en el locus 11q13.1 y la variante ARCL1C corresponde a una cutis laxa con anomalías acompañantes en el pulmón, el tracto gastrointestinal y urinario, que se deben a mutaciones en el gen LTBP4 en el locus 19q13.2.
Las mutaciones en los genes mencionados conducen a una actividad de la lixiloxidasa por debajo del promedio. Se crean conexiones cruzadas inadecuadas debido a la actividad reducida de la enzima. El tejido conectivo del paciente no está suficientemente estabilizado.