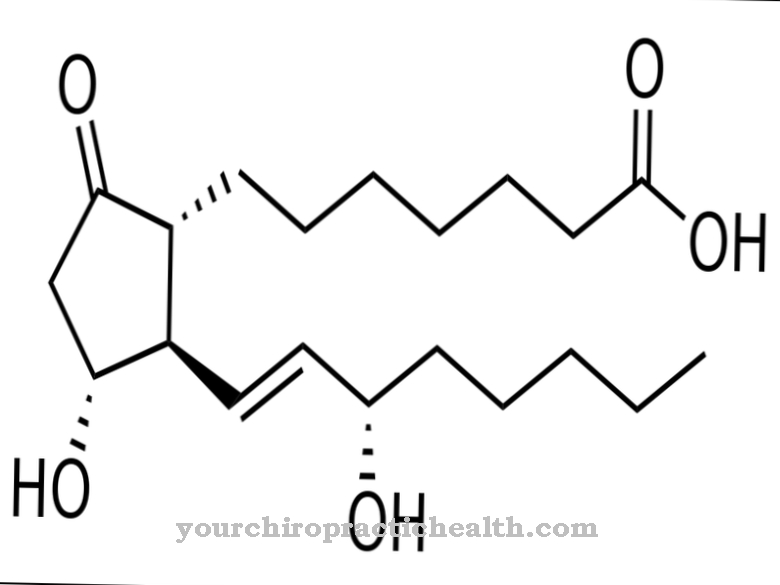
Desmosina es un aminoácido proteinogénico. Junto con otros aminoácidos, forma la fibra y la proteína estructural elastina. Con mutaciones en el gen ELN, se altera la estructura de la elastina.
¿Qué es la desmosina?
Los aminoácidos son una parte importante del organismo humano. Son una clase de compuestos orgánicos que se forman a partir de al menos un grupo carboxi y un grupo amino. Por tanto, los aminoácidos son tanto ácidos carboxílicos como aminas.
Dependiendo de su posición en relación con el grupo carboxi, los aminoácidos pueden asignarse a diferentes grupos. Los aminoácidos con un grupo carboxi terminal se denominan geminales o α y se cuentan entre los α-aminoácidos. Estos aminoácidos son elementos de proteínas. El cuerpo humano tiene más de 20 aminoácidos proteinogénicos y 400 aminoácidos no proteinogénicos. Los D-aminoácidos son un grupo especial. Uno de los más de 20 aminoácidos proteinogénicos es la desmosina, que junto con la isodesmosina construida de manera similar forma la proteína de fibra elastina.
La elastina y su precursor soluble, la tropoelastina, pertenecen a las proteínas estructurales y contribuyen a la formación y retención de estructuras anatómicas. La elastina juega un papel especial en la capacidad de los grandes vasos sanguíneos para estirarse, por ejemplo, la aorta.
Función, efecto y tareas
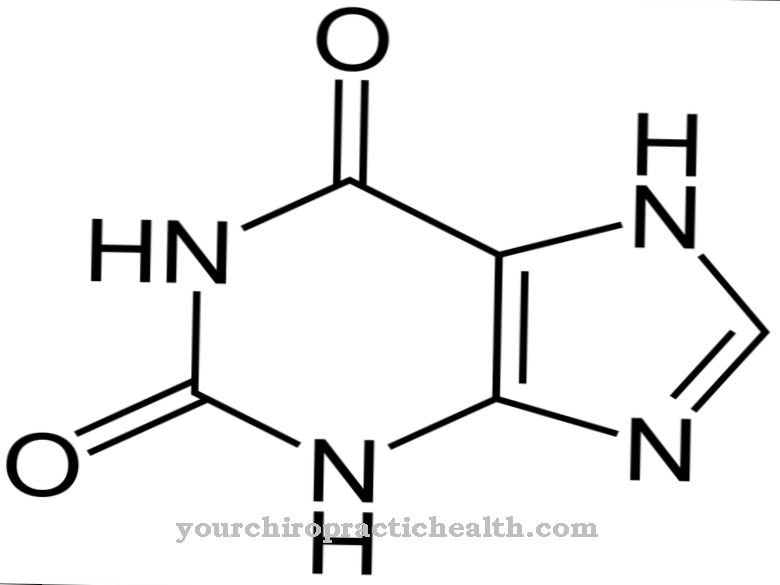
La desmosina es formalmente un aminoácido cuádruple. Tiene un anillo de piridinio en el centro. La piridina es un compuesto químico con la fórmula empírica C5H5N, que puede asignarse a los sistemas parentales heterocíclicos y forma la azina más simple en forma de un anillo de seis miembros con un átomo de nitrógeno y cinco átomos de carbono.
Gracias a su anillo central de piridinio, la desmosina puede interconectar las hebras de proteínas individuales en la proteína de fibra elastina. La composición de la elastina es similar a la del colágeno. Sin embargo, en lugar de hidroxilisina, la elastina tiene una proporción significativa de valina. Los residuos de lisina se oxidan a alisina por la enzima lisil oxidasa. Tres alisinas y una lisina forman a su vez una desmosina en forma de anillo. Esta forma juega un papel importante en la elasticidad de una molécula de elastina completa.
Como red de proteínas, la elastina consta de unidades unidas a desmosina y es elásticamente estirable. Tanto los pulmones como la piel y los vasos sanguíneos dependen de la elastina y de su componente desmosina, ya que es la única forma en que obtienen su considerable elasticidad. La desmosina produce una fluorescencia azul bajo la luz ultravioleta y le da a la elastina su color amarillo, su insolubilidad en agua, estabilidad térmica y resistencia a los álcalis y proteasas.
Educación, ocurrencia, propiedades y valores óptimos
La formación de desmosina también se conoce como biosíntesis de desmosina. Durante esta biosíntesis, los grupos amino terminales de las unidades de L-lisina se convierten en ω-aldehídos por la enzima lisil oxidasa mediante oxidación.
La lisil oxidasa es una proteína lisina 6 oxidasa y, por tanto, corresponde a una enzima que se encuentra en el espacio extracelular del tejido conectivo. En la reticulación de elastina y colágeno, sirve como catalizador y estabilizador mecánico de proteínas. Durante la biosíntesis de la desmosina, la lisil oxidasa convierte la lisina en alisina. Este proceso tiene lugar en la matriz extracelular y estabiliza los enlaces cruzados entre colágeno y elastina, desde un punto de vista químico, la reacción corresponde a la desaminación oxidativa para formar el aldehído. La alisina forma alisinaldol o desmosina con residuos de aldehído de moléculas vecinas de tropelastina a través de una condensación aldólica.
La lisina restante forma una base de Schiff a través de su grupo amino y crea isodesmosina. Además de los vasos sanguíneos, los pulmones y la piel, todas las microfibrillas en particular portan desmosina. Estas son las fibras más pequeñas de tejido colágeno, reticular y elástico.
Enfermedades y trastornos
La formación de elastina a partir de componentes como la desmosina se interrumpe en diversas enfermedades. Estas enfermedades incluyen principalmente mutaciones en el gen ELN. Los más importantes son la dermatocalasia, el síndrome de Williams-Beuren y la estenosis aórtica congénita subvalvular. La dermatocalasia es un grupo de cambios en el tejido conectivo con acumulación familiar.
La característica de este grupo es la piel flácida, menos elástica y arrugada en varias partes del cuerpo. El gen ELN codifica la elastina y puede causar tales síntomas a través de una mutación. El síndrome de Williams-Beuren es bastante raro en comparación con este, y afecta solo a uno de cada 20.000 recién nacidos. La enfermedad es causada por un defecto en el cromosoma siete. El locus del gen es 7q11.23. Debido a un defecto en este punto, la persona afectada carece del gen de elastina y genes vecinos. La deleción del gen de la elastina provoca dismorfismo facial y trastornos en la estructura del órgano interno. Pueden producirse defectos cardíacos como estenosis aórtica supravalvular y malformaciones renales como el riñón en herradura o estenosis vascular renal. Además, suele haber una discapacidad cognitiva.
Las capacidades mentales de los afectados están por debajo del promedio. A pesar de la expresividad verbal, en su mayoría forman oraciones con poco contenido. Empiezan a leer a una edad muy temprana, lo que a menudo sobreestima sus habilidades mentales. Además de su hiperlexia, su tono perfecto a menudo conduce a sobreestimaciones. Como forma de mutación de elastina, la estenosis aórtica congénita subvalvular corresponde a su vez a una malformación cardíaca asociada con un estrechamiento de la arteria principal. La estenosis supravalvular se encuentra sobre la válvula aórtica al comienzo de la aorta.
Esta forma del defecto cardíaco a menudo se caracteriza por constricciones en forma de reloj de arena que se encuentran por encima de la salida de los vasos coronarios. La parte ascendente de la aorta también se puede estrechar. Esta forma de estenosis aórtica ocurre con especial frecuencia en el contexto del síndrome de Williams-Beuren que acabamos de comentar. Este defecto cardíaco ya se ha observado independientemente de la enfermedad. En este caso, sin embargo, no necesariamente tiene que estar relacionado con una mutación en el gen de la elastina.

.jpg)