Los complejos procesos celulares y fisiológicos en los seres vivos requieren una regulación finamente ajustada a nivel molecular para asegurar la adaptabilidad de un animal o una planta, por ejemplo, al hábitat. Para ello, existen numerosas moléculas que intervienen en procesos como la comunicación celular, el metabolismo o la división celular. Una de estas moléculas es la proteína. Calmodulinaque, con la ayuda del calcio, influye en la función de muchas otras proteínas biológicamente activas.
¿Qué es la calmodulina?
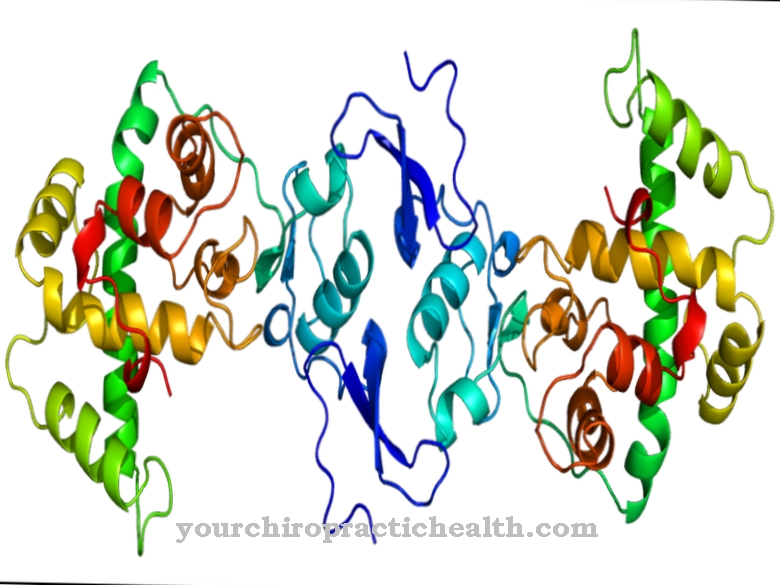
La calcodulina es una proteína reguladora intracelular que se une a los iones de calcio. Por su estructura, pertenece al grupo de proteínas EF-hand. La forma de la calmodulina, que consta de 148 aminoácidos y mide 6,5 nm de largo, se asemeja a una mancuerna. La masa molecular de esta molécula de proteína es de aproximadamente 17 kDa.
Debido a su función biológica en la transmisión de señales dentro de las células, la calmodulina también se puede clasificar como un segundo mensajero, es decir, una sustancia mensajera secundaria que, sin embargo, no es enzimáticamente activa en sí misma. En los dos dominios esféricos de la proteína hay dos motivos hélice-bucle-hélice a una distancia de 1,1 nm, a los que se pueden unir un total de cuatro iones calcio. Esta estructura se conoce como mano EF. Las estructuras de la mano EF están conectadas por enlaces de hidrógeno entre las láminas beta antiparalelas de calmodulina.
Función, efecto y tareas
La calcodulina necesita de tres a cuatro iones de calcio unidos por molécula para estar activa. En estado activado, el complejo calcio-calmodulina formado interviene en la regulación de un gran número de receptores, enzimas y canales iónicos con una amplia variedad de funciones. Las enzimas reguladas incluyen la fosfatasa calcineurina, que juega un papel importante en la regulación de la respuesta inmune, y la óxido nítrico sintasa endotelial (eNOS), que produce NO, que entre otras cosas se usa para la relajación de la musculatura lisa y por lo tanto para una expansión de la Vasos sanguineos.
A bajas concentraciones de calcio, la adenilato ciclasa (AC) también se activa, a altas concentraciones de calcio, por otro lado, la contraparte enzimática, la fosfodiesterasa (PDE). De esta manera, se logra una secuencia cronológica de los mecanismos reguladores: inicialmente el AC pone en movimiento una ruta de señal a través de la producción de AMP cíclico (cAMP), luego esta es apagada nuevamente por la PDE oponente a través de la degradación de cAMP. Sin embargo, el efecto regulador de la calmodulina sobre las proteínas quinasas como CaM quinasa II o miosina quinasa de cadena ligera (MLCK), que se explicará con más detalle a continuación, es particularmente conocido.
El CAMKII puede unir un residuo de fosfato a varias proteínas y así influir en el metabolismo energético, la permeabilidad de los iones y la liberación de neurotransmisores de las células. El CAMKII se encuentra en concentraciones particularmente altas en el cerebro, donde juega un papel importante en la plasticidad neuronal, es decir, todos los procesos de aprendizaje. Pero la calmodulina también es indispensable para los procesos de movimiento. En reposo, la concentración de iones de calcio en una célula muscular es muy baja y, por tanto, la calmodulina está inactiva. Sin embargo, si la célula muscular se excita, el calcio fluye hacia el plasma celular y, como cofactor, ocupa los cuatro sitios de unión de la calmodulina.
Esto ahora puede activar la quinasa de cadena ligera de miosina, que desplaza las fibras contráctiles en la célula y, por lo tanto, permite la contracción muscular. Otras enzimas menos conocidas que están bajo la influencia de la calmodulina son la guanilato ciclasa, Ca-Mg-ATPasa y fosfolipasa A2.
Educación, ocurrencia, propiedades y valores óptimos
La calcodulina se encuentra en todos los eucariotas, que incluyen todas las plantas, animales, hongos y el grupo de criaturas ameboides. Dado que la molécula de calmodulina en estos organismos generalmente está estructurada de una manera relativamente similar, se puede suponer que es una proteína evolutivamente muy antigua que surgió en una etapa temprana.
Como regla general, la calmodulina está presente en cantidades relativamente grandes en el plasma de una célula. En el citosol de las células nerviosas, por ejemplo, la concentración habitual es de alrededor de 30-50 µM, es decir 0.03-0.05 mol / L. La proteína se forma durante la transcripción y traducción utilizando el gen CALM, del cual existen tres alelos conocidos hasta la fecha, que se conocen como CALM-1, CALM-2 y CALM-3.
Enfermedades y trastornos
Hay algunos productos químicos que pueden tener un efecto inhibidor sobre la calmodulina y, por lo tanto, se conocen como inhibidores de la calmodulina. En la mayoría de los casos, su efecto inhibidor se basa en el hecho de que transportan calcio fuera de la célula y así lo eliminan de la calmodulina, que entonces solo está presente en estado inactivo.
Estas sustancias inhibidoras incluyen, por ejemplo, W-7. Además, algunos fármacos fenotiazínicos psicotrópicos inhiben la calmodulina. Tan amplias como las funciones reguladoras de la calmodulina, tan diversos son los defectos y trastornos concebibles cuando la proteína ya no puede ser activada por el cofactor calcio y las enzimas diana reguladas también son menos activas. La activación inadecuada del CAMKII, por ejemplo, puede conducir a una limitación de la plasticidad neuronal, que forma la base de los procesos de aprendizaje.
La disminución de la activación de la MLCK altera la contracción de los músculos, lo que puede provocar trastornos del movimiento. Una menor activación de la enzima calcineurina debido a una deficiencia de calmodulina influiría en la respuesta inmune del cuerpo y una menor activación de los eNOs conduciría a concentraciones más bajas de NO. Este último causa principalmente problemas donde, de lo contrario, se supone que el óxido nítrico previene la coagulación sanguínea no deseada y dilata los vasos con el fin de mejorar la circulación sanguínea. Sin embargo, también debe mencionarse en este punto que el sensor de calcio Frequenin puede asumir las funciones biológicas de la calmodulina bajo ciertas condiciones y así reemplazar la molécula.

.jpg)










.jpg)