Aproximadamente la mitad de todas las proteínas se encuentran en el cuerpo humano. Glicoproteínas. Las sustancias juegan un papel como componentes celulares y también como sustancias inmunes. Se forman principalmente como parte de la denominada N-glicosilación y, si se ensamblan incorrectamente, pueden causar enfermedades graves.
¿Qué son las glicoproteínas?
Las glicoproteínas son proteínas con residuos de heteroglicanos ramificados en forma de árbol. Suelen tener una consistencia viscosa. Las macromoléculas contienen grupos de azúcar unidos covalentemente.
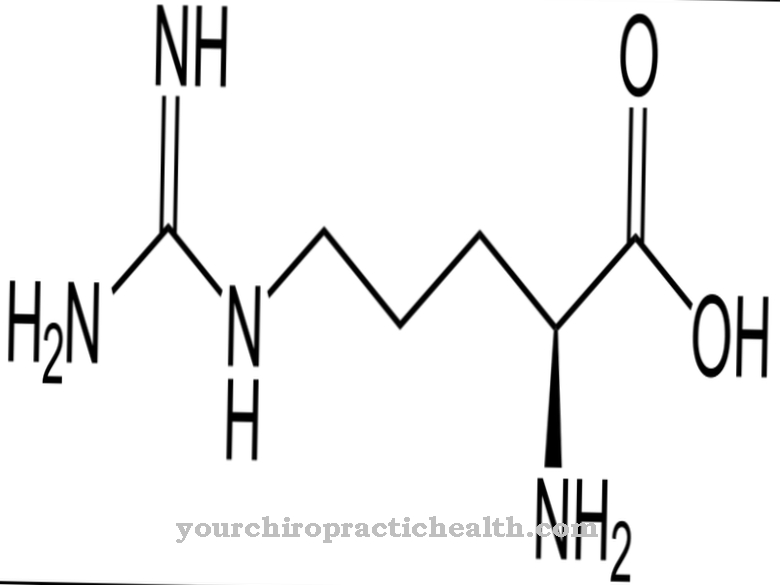
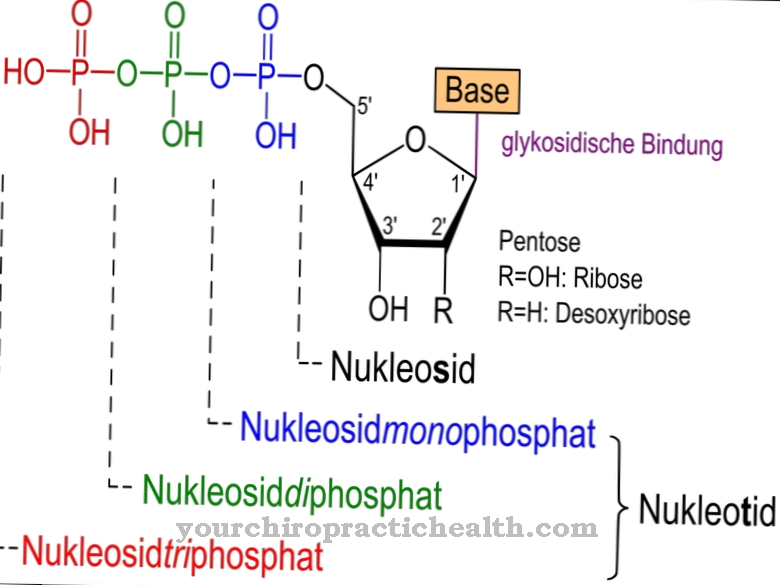
Se componen de monosacáridos como glucosa, fructosa, manosa o aminoazúcar acetilado. Por eso también se les conoce como oligosacáridos unidos a proteínas. El enlace covalente puede tener lugar de diferentes formas y corresponde a un enlace a los aminoácidos serina o asparagina. El enlace a la serina se llama O- y el de la asparagina a N-glicosilación. Las glicoproteínas involucradas en la N-glicosilación varían en tamaño. Corresponden a monosacáridos, di u oligosacáridos e incluso polisacáridos.
Según su proporción de monosacáridos, se dividen en glucoproteínas con alto contenido de manosa, complejas e híbridas. En el grupo rico en manosa, predominan los residuos de manosa. En el grupo complejo, predominan los sacáridos. El grupo híbrido es un híbrido. El contenido de carbohidratos de las glicoproteínas está entre un pequeño porcentaje para las ribonucleasas y hasta un 85 por ciento para los antígenos de grupos sanguíneos.
Función, efecto y tareas
Las glicoproteínas cumplen numerosas funciones en el organismo humano. Son un componente estructural de las membranas celulares y también se denominan proteínas estructurales en este contexto. También se encuentran en el moco y se utilizan como lubricantes en líquidos.
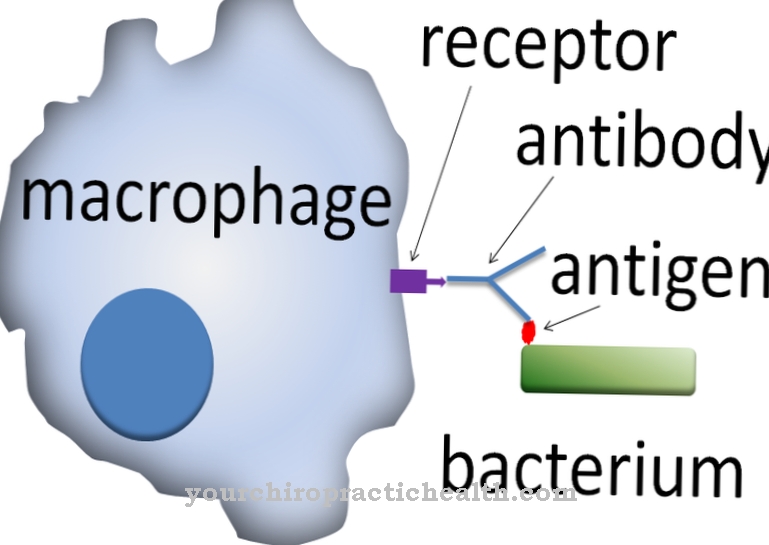
Como proteínas de membrana, contribuyen a la interacción celular. Algunas glicoproteínas también tienen funciones hormonales, como el factor de crecimiento hCG. Las sustancias son tan importantes como los componentes inmunológicos en forma de inmunoglobulinas e interferones. Todas las proteínas de exportación y proteínas de membrana del cuerpo seguían siendo glucoproteínas, al menos durante la biosíntesis. Son particularmente relevantes para las reacciones de reconocimiento en el sistema inmunológico, ya que interactúan con células T inmunológicas y receptores de células T. Se han aislado varias proteínas plasmáticas en el plasma sanguíneo humano, de las cuales solo la albúmina y la prealbúmina no tienen residuos de azúcar.
La abundancia de glucoproteínas es asombrosa. En última instancia, casi todas las proteínas y enzimas extracelularmente solubles tienen residuos de azúcar. Como hormonas, las glicoproteínas tienen un efecto pleiotrópico y, por lo tanto, son cruciales para la actividad de varios sistemas orgánicos. Las hormonas TSH, HCG y FSH son, por ejemplo, glicoproteínas. Como proteínas de membrana, están representadas en el papel de receptor, así como de transportador y estabilizador. Tienen un efecto estabilizador, especialmente junto con los glicolípidos. Junto con estas sustancias forman el llamado glucocáliz, que estabiliza las células sin paredes celulares.
Educación, ocurrencia, propiedades y valores óptimos
La forma más común de formación de glicoproteínas es el enlace N-glicosídico o N-glicosilación a asparagina. El azúcar se une a los grupos amida de ácido libres de nitrógeno. La N-glicosilación tiene lugar en el retículo endoplásmico. Los N-glucósidos así formados son el grupo de glucoproteínas más relevante.
En la N-glicosilación, el precursor del azúcar snythetiza en la molécula portadora dolicol independientemente de la secuencia de aminoácidos de la proteína diana. El grupo OH al final de la molécula está unido al difosfato. Se forma un precursor de oligosacárido en el residuo fosfato terminal de las moléculas. Los primeros siete azúcares se ensamblan en el lado citosólico. Dos N-acetil-glucosaminas y cinco residuos de manosa se unen al dolicol fosfato. Los nucleótidos de azúcar GDP-manosa y UDP-N-acetil-glucosamina aparecen como donantes. El precursor se transporta a través de la membrana del RE a través de una proteína de transporte.
Esto significa que la etapa preliminar se orienta hacia el interior del retículo endoplásmico, donde se le añaden cuatro residuos de manosa. Además, se cultivan residuos de glucosa. El precursor de 14 azúcares de largo finalmente se transfiere a una proteína. Otra vía de formación de las glicoproteínas es el enlace O-glicosídico o la O-glicosilación a la serina, que tiene lugar en el aparato de Golgi de las células. El azúcar está unido a un grupo hidroxilo de la serina. Los valores de glicoproteínas son particularmente relevantes en relación con las proteínas plasmáticas, ya que desempeñan un papel en un hemograma completo. Enumerar todos los valores normales para las glicoproteínas individualmente en este punto iría más allá del alcance.
Enfermedades y trastornos
Algunas enfermedades genéticas tienen efectos sobre la glicosilación. Un grupo de tales enfermedades es CDG. Las glicoproteínas muestran valores anormales. Los afectados sufren de un desarrollo lento, que se relaciona con problemas físicos y mentales.
El estrabismo puede ser otro síntoma del trastorno genético. Un total de alrededor de 250 genes diferentes están involucrados en la formación de glocoproteínas. En el caso de los trastornos de glicosilación congénitos, los trastornos en la unión de las cadenas laterales de carbohidratos a las proteínas están presentes debido a una disposición genética. En la modificación postraduccional, las proteínas reciben su funcionalidad completa. En este proceso, cuando las enzimas o proteínas que forman las cadenas laterales de carbohidratos se ensamblan de manera anormal, se crea CDG. La N-glicosilación es la más comúnmente afectada por trastornos. Hasta ahora, se han descubierto alrededor de 30 defectos enzimáticos que tienen un impacto en la N-glicosilación.
Los trastornos genéticos de O-glicosilación son algo más raros. Se manifiestan en enfermedades neuromusculares multisistémicas como el síndrome de Walker-Warburg. Dado que las glicoproteínas asumen tantas funciones en el organismo, el cuadro clínico se caracteriza por una variedad de síntomas. Todos los sistemas de órganos pueden verse afectados por trastornos congénitos de la glicosilación. Los trastornos del desarrollo psicomotor son el síntoma principal. Las anomalías neurológicas son igualmente comunes. Los trastornos de la coagulación o los trastornos endocrinos tampoco son infrecuentes.


.jpg)