Ácido oxálico, también conocido como Ácido etanodioico o Ácido de trébol, es la forma más simple de ácido dicarboxílico. La fórmula C2H2O4 es un sólido cristalino que es incoloro e inodoro. El estado físico del ácido oxálico es sólido.
¿Qué es el ácido oxálico?
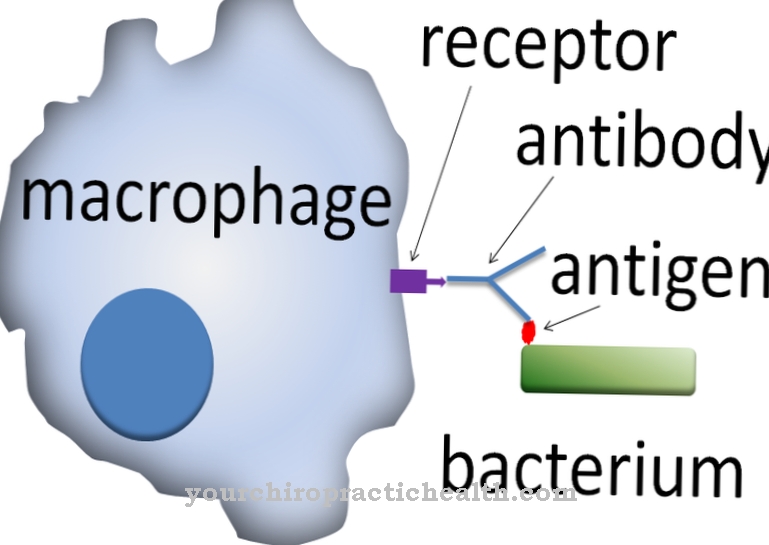
Como agente reductor, el ácido oxálico se determina mediante titulación con agentes oxidantes como el permanganato de potasio. Este proceso produce dióxido de carbono como producto de oxidación. Las sales de ácido oxálico se conocen con el nombre sistemático de etanodioato, oxalato.
El ácido oxálico se descubrió ya en 1769. Johann Christian Wiegleb descubrió este ácido en la acedera de madera como la sal de potasio. Derivado de la acedera de madera, el nombre histórico Kleesäure se mantuvo, por lo tanto, en el uso lingüístico. En 1776, Carl Wilhelm Scheele y Torbern Olof Bergman lograron producir ácido oxálico oxidando el azúcar junto con el ácido nítrico. Sin embargo, este proceso no es una síntesis, sino solo la descomposición de una sustancia natural. La producción artificial de ácido oxálico tuvo éxito por primera vez en 1824. Friedrich Wöhler sintetizó ácido oxálico por saponificación de dician a partir de materias primas inorgánicas.
Función, efecto y tareas
El ácido oxálico es ideal para eliminar las manchas de óxido y también se utiliza como agente blanqueador. Los apicultores utilizan ácido oxálico, especialmente en invierno, para combatir el ácaro varroa. La solución de azúcar al 3,5 por ciento, que es muy acuosa, se rocía o se gotea sobre las abejas.
Sin embargo, los apicultores que tratan la varroosis con ácido oxálico corren el riesgo de tener contacto directo con el ácido. El ácido oxálico también se utiliza en el laboratorio como sustancia de título básico para la manganometría, ya que para ello se puede utilizar el dihidrato de ácido oxálico. El ácido oxálico también es adecuado como sustancia de título básico para la determinación precisa del contenido de soluciones estándar alcalinas como la solución de hidróxido de sodio. Debido a la formación de una sal de calcio poco soluble, el ácido oxálico es útil para la determinación gravimétrica de un ión de calcio como oxalato de calcio.
El ácido oxálico, que se obtiene de la acedera de madera de Fichtelgebirge, también se usa para el blanqueo efectivo del cuarzo, es decir, el cristal de roca, cuya presencia está particularmente probada en la ciudad de Weißenstadt. El ácido oxálico favorece el pulido brillante del mármol y se utiliza en la industria de la madera como blanqueador suave. Elimina las manchas que han surgido de forma reactiva como reacción de ácidos tánicos o por contacto con madera que contiene ácido tánico con herramientas de hierro. La química farmacéutica se beneficia del efecto del ácido oxálico a través de su propiedad como formador de sal.
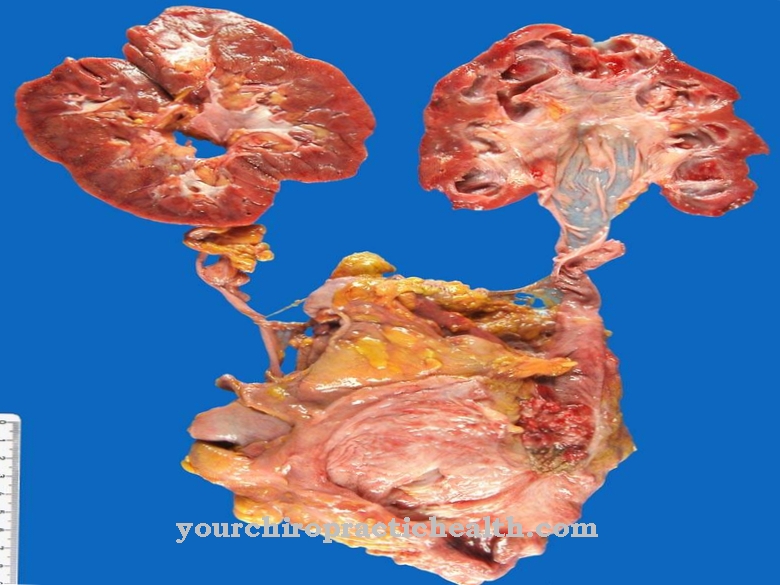
La protonación de aminas básicas produce los llamados oxalatos. El ácido oxálico también se encuentra en cantidades muy pequeñas en el té negro, el té de menta y en las raíces y la corteza de muchas plantas como oxalatos de calcio insolubles. El ácido oxálico no es dañino para la salud en pequeñas cantidades, pero es dañino en concentraciones más altas. Los oxalatos de calcio a menudo se producen en la naturaleza por la muerte de células vegetales. Los cálculos renales también constan de este oxalato de calcio y ácido úrico, pero la formación de cálculos renales se previene consumiendo frutas que contienen ácido cítrico.
Educación, ocurrencia, propiedades y valores óptimos
El ácido oxálico y la sal de potasio se encuentran en grandes cantidades en plantas nudosas como el ruibarbo, que pueden contener alrededor de 180 a 765 miligramos por 100 gramos de peso fresco y tallos. En la acedera, la mayor parte del ácido oxálico se encuentra en las hojas.
Los frutos estrella contienen entre 40 y 1000 miligramos por cada 100 gramos de sustancia fresca, similar a la acedera. La acelga contiene entre 110 y 940 miligramos por 100 gramos de peso fresco. La espinaca contiene de 120 a 1330 miligramos, mientras que el perejil a 100 gramos de peso fresco solo contiene hasta 185 miligramos. El ácido oxálico y su sal de potasio también se encuentran en el cacao con 338 a 480 miligramos en 100 gramos y en el chocolate con 80 a 200 miligramos. 100 gramos de remolacha fresca contienen entre 17 y 329 miligramos.
Muchos hongos secretan ácido oxálico, que es promovido por la producción de una reacción alcalina de la solución nutritiva. El ácido oxálico se obtiene calentando rápidamente el formiato de sodio a 360 grados Celsius. Alrededor de 140.000 toneladas de ácido oxálico, incluidos ésteres, se producen anualmente en todo el mundo. El ácido fuerte se degrada a temperaturas superiores a 150 grados Celsius con la formación de dióxido de carbono, monóxido de carbono y agua.
Enfermedades y trastornos
El ácido oxálico altera la absorción de hierro en el intestino, por lo que conviene reducir el consumo de alimentos con ácido oxálico. El calcio puede reducirse en el tejido afectado, lo que en el peor de los casos podría dañar el corazón.
En general, incluso una intoxicación menor como resultado de la obstrucción de los túbulos renales conduce a daño renal. El contacto directo regular con el ácido oxálico puede representar riesgos para la salud, como para los apicultores que usan ácido oxálico para combatir la varroosis. Aunque el ácido oxálico tiene mala reputación en relación con los alimentos, se cree que el ácido tiene propiedades positivas en la defensa frente a enfermedades como las aflatoxinas y el Aspergillus.
Se ha comprobado que un valor demasiado alto de oxalato tiene un efecto negativo sobre el organismo humano, ya que reduce sustancias importantes para el organismo como el magnesio, zinc, potasio y calcio. En pequeña medida, el consumo de ácido oxálico en los alimentos no debería causar ningún efecto nocivo, ya que diferentes tipos de verduras como la acelga, el ruibarbo o la acedera son saludables. Con moderación, los alimentos con alto contenido en oxalatos y ácido oxálico tienen efectos saludables como las espinacas o el consumo moderado de té definitivamente tiene sus efectos positivos.

.jpg)