Miosina Pertenece a las proteínas motoras y es responsable, entre otras cosas, de los procesos implicados en la contracción muscular. Existen diferentes tipos de miosinas, todas las cuales participan en los procesos de transporte de orgánulos celulares o en cambios dentro del citoesqueleto. Las desviaciones estructurales en la estructura molecular de la miosina pueden, en determinadas circunstancias, ser la causa de enfermedades musculares.
¿Qué es la miosina?
Junto con la dineína y la kinesina, la miosina es una de las proteínas motoras responsables de los procesos de movimiento y transporte celular dentro de la célula. A diferencia de las otras dos proteínas motoras, la miosina solo funciona con actina. La actina, a su vez, forma parte del citoesqueleto de la célula eucariota. Por tanto, es responsable de la estructura y estabilidad de la célula.
Además, la actina con miosina y otras dos proteínas estructurales forman la unidad estructural contráctil real del músculo. Dos tercios de las proteínas contráctiles del músculo son miosinas y un tercio son actina. Sin embargo, las miosinas no solo están presentes en las células musculares, sino también en todas las demás células eucariotas. Esto se aplica tanto a eucariotas unicelulares como a células vegetales y animales. Los microfilamentos (filamentos de actina) intervienen en la estructura del citoesqueleto de todas las células y, junto con la miosina, controlan las corrientes protoplásmicas.
Anatomía y estructura
Las miosinas se pueden dividir en diferentes clases y subclases. Actualmente se conocen más de 18 clases diferentes, siendo las clases I, II y V las más importantes. La miosina que se encuentra en la fibra muscular se llama miosina convencional y pertenece a la clase II. La estructura de todas las miosinas es similar. Todos constan de una parte de la cabeza (cabeza de miosina), una parte del cuello y una parte de la cola.
Los filamentos de miosina del músculo esquelético constan de alrededor de 200 moléculas de miosina II, cada una con un peso molecular de 500 kDa. La cabecera es genéticamente muy conservadora. La división en clases estructurales está determinada principalmente por la variabilidad genética de la parte de la cola. La parte de la cabeza se une a la molécula de actina, mientras que la parte del cuello actúa como bisagra. Las partes de la cola de varias moléculas de miosina se acumulan y forman filamentos (haces). La molécula de miosina II consta de dos cadenas pesadas y cuatro ligeras.
Las dos cadenas pesadas forman un llamado dímero. La más larga de las dos cadenas tiene una estructura de hélice alfa y está formada por 1300 aminoácidos. La cadena más corta, compuesta por 800 aminoácidos, representa el llamado dominio motor y forma la parte principal de la molécula, responsable de los movimientos y procesos de transporte. Las cuatro cadenas ligeras están conectadas a la cabeza y al cuello de las cadenas pesadas. Las cadenas ligeras más alejadas de la cabeza se denominan reguladoras y las cadenas ligeras cercanas a la cabeza como cadenas esenciales. Son muy afines al calcio y, por lo tanto, pueden controlar la movilidad de la parte del cuello.
Función y tareas
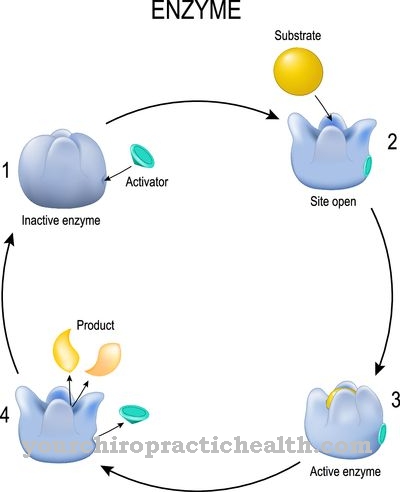
La función más importante de todas las miosinas es transportar orgánulos celulares en células eucariotas y realizar cambios dentro del citoesqueleto. Las moléculas convencionales de miosina II, junto con la actina y las proteínas tropomiosina y troponina, son responsables de la contracción muscular. Para hacer esto, la miosina se integra primero en los discos Z del sacomer usando la proteína titina. Seis filamentos de titina fijan un filamento de miosina.
En el sacomer, un filamento de miosina forma alrededor de 100 conexiones cruzadas a los lados. Según la estructura de las moléculas de miosina y el contenido de mioglobina, se pueden distinguir varias formas de fibras musculares. La contracción muscular tiene lugar dentro del sacomer debido al movimiento de la miosina en el ciclo de puente cruzado. En primer lugar, la cabeza de miosina está firmemente unida a la molécula de actina. Luego, el ATP se divide en ADP, por lo que la energía liberada conduce a la tensión de la cabeza de miosina. Al mismo tiempo, las cadenas ligeras aseguran un aumento de iones calcio. Esto hace que la cabeza de miosina se adhiera a una molécula de actina vecina como resultado de un cambio conformacional.
Al liberar la conexión anterior, la tensión se convierte ahora en energía mecánica mediante un llamado impacto de fuerza. El movimiento es similar a un golpe de remo. La cabeza de la miosina se inclina de 90 grados a entre 40 y 50 grados. El resultado es el movimiento muscular. Durante la contracción muscular, solo se acorta la longitud del sacomer, mientras que las longitudes de los filamentos de actina y miosina permanecen iguales. El suministro de ATP en el músculo solo es suficiente durante unos tres segundos. Al descomponer la glucosa y la grasa, el ADP se convierte nuevamente en ATP para que la energía química aún se pueda convertir en energía mecánica.
Enfermedades
Los cambios estructurales en la miosina causados por mutaciones pueden provocar enfermedades musculares. Un ejemplo de tal enfermedad es la miocardiopatía hipertrófica familiar. La miocardiopatía hipertrófica familiar es una enfermedad hereditaria que se hereda como un rasgo autosómico dominante. La enfermedad se caracteriza por un engrosamiento del ventrículo izquierdo sin dilatación.
Con una prevalencia del 0,2 por ciento en la población general, es una enfermedad cardíaca relativamente común. Esta enfermedad es causada por mutaciones que conducen a cambios estructurales en betamiosina y alfatropomiosina. Esta no es una, sino varias mutaciones puntuales de las proteínas involucradas en la estructura del sacomer. La mayoría de las mutaciones se localizan en el cromosoma 14. Patológicamente, la enfermedad se manifiesta como un engrosamiento de los músculos del ventrículo izquierdo.
Esta asimetría en el grosor del miocardio puede provocar molestias cardiovasculares con arritmias cardíacas, dificultad para respirar, mareos, pérdida del conocimiento y angina de pecho. Aunque muchos pacientes tienen poco o ningún deterioro de su función cardíaca, se puede desarrollar insuficiencia cardíaca progresiva.

.jpg)





.jpg)



.jpg)