Lisil hidroxilasas representan un grupo de enzimas que son responsables de la hidroxilación de residuos de lisina dentro de las proteínas. Por lo tanto, contribuyen principalmente a la estructura del tejido conectivo. Las alteraciones en la función de las lisil hidroxilasas se expresan en enfermedades como el escorbuto o el síndrome de Ehlers-Danlos hereditario.
¿Qué son las lisil hidroxilasas?
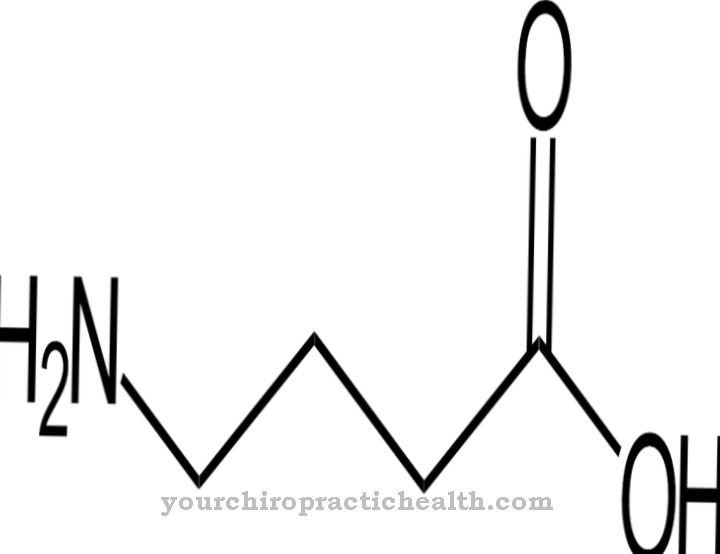
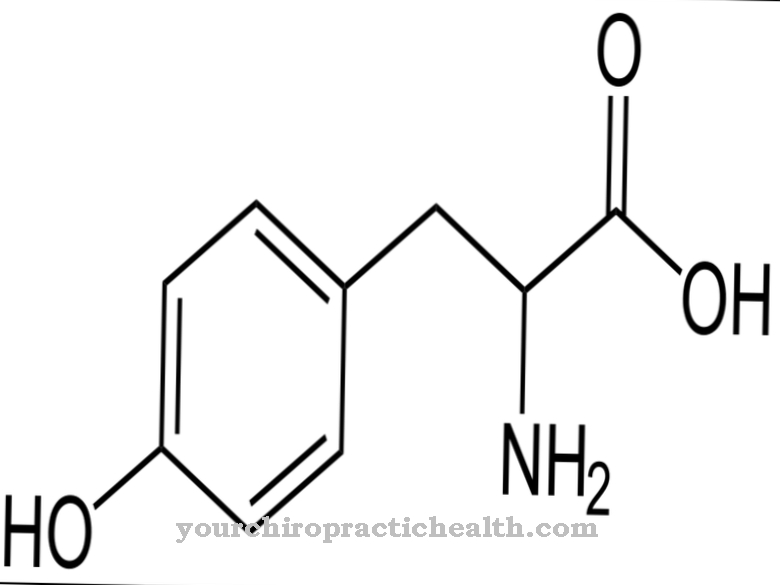
Las lisil hidroxilasas son enzimas cuyo trabajo es catalizar la modificación postraduccional del aminoácido lisina incorporando un grupo hidroxilo en hidroxil lisina. Esto fortalece el tejido conectivo porque sus cadenas de proteínas tienen la oportunidad de conectarse más a través de los grupos hidroxilo.
La lisil hidroxilasa humana consta de 727 aminoácidos. Las lisil hidroxilasas también pertenecen al grupo de las hidroxilasas, es decir, enzimas que generalmente catalizan la incorporación de grupos hidroxilo en moléculas. Además de las lisil hidroxilasas, las hidroxilasas u oxidorreductasas también incluyen prolil hidroxilasas, fenilalanina hidroxilasa, tirosina hidroxilasa o triptófano hidroxilasa. Especialmente junto con las prolil hidroxilasas, las lisil hidroxilasas juegan un papel importante en la función del tejido conectivo. Ambos grupos de enzimas requieren la coenzima vitamina C para su función.
Función, efecto y tareas
La función de las lisil hidroxilasas consiste exclusivamente en catalizar la incorporación de grupos hidroxilo en residuos de lisina dentro de una proteína. En el curso de una modificación postraduccional, el aminoácido hidroxilamina se forma a partir de lisina.
Aunque la hidroxilamina también es gratuita, no se puede incorporar a la proteína en esta forma. Por lo tanto, la modificación postraduccional significa la conversión posterior de este aminoácido después de que se haya acumulado la proteína. Cuando un átomo de hidrógeno se intercambia por el grupo hidroxilo, en este punto se incorpora a la proteína un grupo funcional que puede realizar funciones de puente. Con la ayuda del grupo hidroxilo, pueden unirse diferentes cadenas de proteínas. Además, las moléculas de azúcar pueden unirse a este grupo funcional. Ambas reacciones son muy importantes, entre otras cosas, en el desarrollo del tejido conectivo.
El tejido conectivo encierra el organismo y los órganos internos. Tiene que ser firme y tenso para poder diferenciar entre los órganos funcionalmente diferentes. Esto está asegurado por las proteínas del tejido conectivo, que contienen un alto porcentaje de los aminoácidos lisina y prolina.Para ello, posteriormente se modifican parcialmente ambos aminoácidos tras su incorporación a la proteína mediante la adición de un grupo hidroxilo. Como ya se mencionó, con prolina esta reacción es catalizada por prolil hidroxilasas y con lisina por lisil hidroxilasas. Después de la formación de proteínas, estas reacciones de modificación crean una red de cadenas de proteínas que representan tejido conectivo estrecho.
Sin la función de ambas enzimas, el desarrollo de tejido conectivo funcional no sería posible en absoluto. Sin embargo, ambas enzimas solo funcionan con la ayuda de la coenzima ácido ascórbico, es decir, vitamina C.En el caso de enzimas estructuralmente alteradas por mutación o falta de vitamina C, esto puede provocar una alteración en la estructura del tejido conectivo y, por lo tanto, enfermedades graves.
Educación, ocurrencia, propiedades y valores óptimos
El gen PLOD1 es responsable de codificar la lisil hidroxilasa humana. El nombre PLOD1 se deriva del nombre de la lisil hidroxilasa "Procolágeno-Lisina, 2-Oxoglutarat-5-Dioxigenasa 1". Este gen se encuentra en el cromosoma 1. Dado que se produce constantemente tejido conectivo nuevo, también existe una necesidad permanente de producción de lisil hidroxilasas. Por tanto, una mutación de este gen puede tener consecuencias muy graves para la salud del organismo.
Enfermedades y trastornos
Las alteraciones en la función de las lisil hidroxilasas juegan un papel particularmente importante en el escorbuto y el síndrome de Ehlers-Danlos. El escorbuto se conoce como una antigua enfermedad de los marineros, causada por la falta de vitamina C. La vitamina C, también conocida como ácido ascórbico, funciona como coenzima de lisil hidroxilasas y prolil hidroxilasas. Si falta, los aminoácidos lisina y prolina en la proteína del tejido conectivo ya no pueden hidroxilarse.
Dado que hay una constante acumulación y degradación de las proteínas del tejido conectivo, las cadenas de proteínas son cada vez menos capaces de conectarse en red durante el período de deficiencia de vitaminas. El tejido conectivo se afloja y ya no puede cumplir su función correctamente. Se presenta una amplia gama de síntomas, que incluyen agotamiento general, susceptibilidad a infecciones, encías sangrantes, pérdida de dientes, mala cicatrización de heridas, problemas graves de la piel, atrofia muscular y muchos otros problemas de salud. En última instancia, el escorbuto puede provocar la muerte por insuficiencia cardíaca general o infecciones graves. Los antiguos marinos se vieron particularmente afectados porque no podían obtener suficiente vitamina C durante los largos viajes en el mar.
Se ha demostrado que la enfermedad se cura inmediatamente cuando se administran ciertos alimentos como el chucrut. Solo más tarde se reconoció que la causa de la enfermedad era una deficiencia de vitamina C. El brote de escorbuto, la enfermedad de la gente de mar, se evitó posteriormente alimentando a los marinos con chucrut. Otra enfermedad, que sólo puede atribuirse parcialmente a un defecto en la lisil hidroxilasa humana, es el síndrome de Ehlers-Danlos. El síndrome de Ehlers-Danlos es un término colectivo para varias enfermedades hereditarias del tejido conectivo con diferentes causas. Este síndrome se caracteriza por una debilidad severa del tejido conectivo.
La piel se puede estirar demasiado y las articulaciones se pueden mover demasiado. Una lisil hidroxilasa modificada genéticamente desencadena el síndrome de Ehlers-Danlos tipo VI. Un gen mutado llamado PLOD1, que se encuentra en el cromosoma 1, es responsable de esto. La enzima defectuosa formada a partir de esto ya no es completamente funcional y solo puede catalizar de manera insuficiente las reacciones de hidroxilación en lisina. Se desarrolla un tejido conectivo débil con los síntomas conocidos, así como una participación adicional de los ojos y los órganos internos. El síndrome de Ehlers-Danlos tipo VI puede heredarse como un rasgo autosómico recesivo.

.jpg)



.jpg)
.jpg)
.jpg)




.jpg)
.jpg)



.jpg)