los Ajuste inducido-La teoría se remonta a Koshland y corresponde a una extensión del principio de bloqueo de teclas, que se basa en la precisión de ajuste de las estructuras anatómicas. El ajuste inducido se refiere a enzimas como la quinasa que cambian su conformación para formar un complejo enzima-ligando. En el caso de defectos enzimáticos, el principio de ajuste inducido puede verse afectado por trastornos.
¿Qué es el ajuste inducido?

Muchos procesos en el cuerpo funcionan según el principio de bloqueo de llave o de mano en guante. Esto se aplica, por ejemplo, a las conexiones articuladas. La cabeza de la articulación encaja en el receptáculo de la articulación como una llave en una cerradura o una mano en un guante. La puerta solo se abre cuando la llave está exactamente en la cerradura. En el mismo contexto, ciertas funciones del cuerpo solo se abren cuando las estructuras se encuentran con precisión.
El ajuste inducido es una forma especial del principio de llave en llave. Esta es una teoría para la formación de complejos proteína-ligando, por ejemplo un complejo enzima-sustrato en el contexto de reacciones catalizadas por enzimas.
Se considera que Daniel E. Koshland es el primero en describir la teoría y la postuló por primera vez en 1958. A diferencia del principio de bloqueo de teclas, la teoría del ajuste inducido no asume dos estructuras estáticas. En el caso de complejos de proteína-ligando en particular, un cambio conformacional en la proteína involucrada debería permitir la formación del complejo. Ligando y proteína, o más bien enzima, Koshland consideró dinámicos y habló de una interacción que mueve a ambos socios a un cambio en la conformación en aras de la formación del complejo.
Función y tarea
Existe una especificidad de unión entre enzimas y sustratos. Esta especificidad vinculante implica el principio de bloqueo de teclas. Cada enzima tiene un centro activo. Para la formación compleja con un ligando, este centro se forma con precisión de tal manera que coincide casi perfectamente con la forma espacial del sustrato previsto.
En el caso de muchas enzimas, sin embargo, el centro activo en cada caso está en una forma que no es muy precisa siempre que no esté unido a un sustrato. Esta observación parece contradecir el principio de bloqueo y llave, porque las enzimas y sus ligandos parecen inicialmente adaptar su forma.
Tan pronto como la enzima se adhiere a un ligando, se crean interacciones intermoleculares. Estas interacciones a nivel intermolecular conducen a un cambio en la conformación de la enzima. Se entiende por conformación las diversas disposiciones posibles de átomos individuales en una molécula que resultan de una simple rotación alrededor de un eje. El cambio en la conformación de las enzimas corresponde a un cambio en la disposición espacial de sus moléculas y solo permite la formación de un complejo enzima-sustrato.
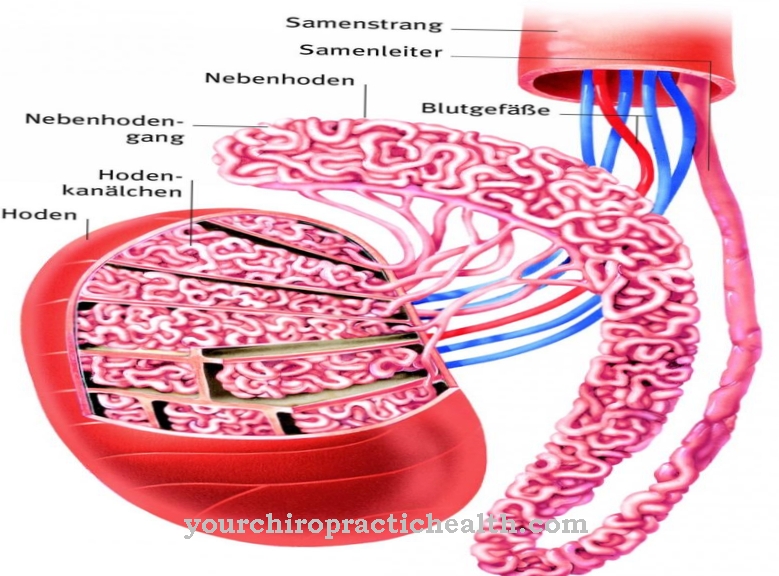
La hexoquinasa como enzimas catalizan, por ejemplo, el primer paso de la glucólisis. Tan pronto como estas enzimas entran en contacto con el sustrato glucosa, se puede observar un ajuste inducido en el sentido de la formación de un "ajuste inducido". La enzima hexoquinasa fosforila su ligando glucosa al consumir ATP para formar una glucosa-6-fosfato.
La estructura del agua se parece a la del grupo alcohólico del átomo de C6, que la enzima fosforila durante la reacción. Debido al pequeño tamaño, las moléculas de agua podrían adherirse al centro activo de la enzima, por lo que se generaría la hidrólisis del ATP. Sin embargo, el ajuste inducido permite que la hexoquinasa catalice la conversión de glucosa con alta especificidad, por lo que la hidrólisis de ATP debe tener lugar en una pequeña extensión. Con el mecanismo de ajuste inducido, aumenta la especificidad del sustrato.
El principio dentro del organismo humano se puede observar particularmente en el caso de las quinasas. La adaptación inducida no se aplica a todos los complejos ligando-receptor, ya que el cambio conformacional de ambos socios es en muchos casos límites naturales.
Enfermedades y dolencias
El principio de ajuste inducido se altera en el caso de diferentes defectos enzimáticos. En la fenilcetonuria, por ejemplo, las enzimas están restringidas en su actividad o fallan por completo. Por lo general, esto se debe a un defecto genético. En la fenilcetonuria, la enzima fenilalanina hidroxilasa es defectuosa. La fenilalanina ya no se convierte en tirosina y se acumula en consecuencia. Surgen sustancias neurotóxicas, por lo que además de las discapacidades mentales, el paciente tiene tendencia a sufrir calambres. Los defectos enzimáticos suelen ser genéticos y son causados por una secuencia de aminoácidos codificada incorrectamente en el ADN.
Las enfermedades metabólicas causadas por defectos enzimáticos y un principio de ajuste inducido alterado se conocen como enzimopatías. Los defectos de la piruvato cinasa están presentes, por ejemplo, en un gen PKLR que codifica incorrectamente. Este gen se encuentra en el locus génico 1q22 del cromosoma 1. Se conocen varias mutaciones del alelo PKLR de la piruvato quinasa, que se manifiestan como defectos en la forma R.
La enfermedad de Hers se denomina nuevamente glucogenosis tipo VI y pertenece al grupo de enfermedades por almacenamiento de glucógeno. Es un trastorno metabólico autosómico recesivo o ligado al cromosoma X debido a defectos enzimáticos. Más precisamente, la causa radica en diferentes defectos enzimáticos del sistema fosforilasa quinasa en el hígado y los músculos. Se conocen en este contexto, por ejemplo, el defecto de la fosforilasa b-quinasa ligada al cromosoma X en el hígado, el defecto de la fosforilasa hepática en la herencia autosómica recesiva y el fallo combinado de la fosforilasa b-quinasa en el hígado y los músculos.
En relación con la fosforilasa hepática, las mutaciones causantes se localizaron en el gen PYGL y, por lo tanto, se encuentran en el cromosoma 14q21 a q22. La deficiencia combinada de fosforilasa del músculo hepático se ha relacionado con mutaciones en el gen PHKB en el locus 16q12-q13. Se identificaron mutaciones causales en el gen PHKA2 en el locus Xp22.2-p22.1 para el defecto ligado al cromosoma X en la fosforilasa quinasa hepática. Otras glucogenosas también pueden anular el efecto de ajuste inducido de la quinasa correspondiente o hacerlo más difícil.



.jpg)
.jpg)
.jpg)


.jpg)


.jpg)