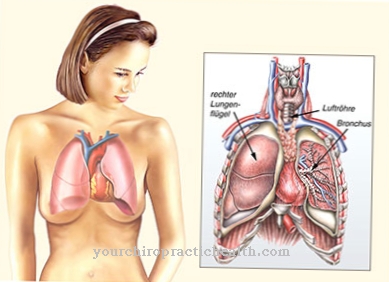
los Síntesis de hemoglobina está compuesto por la síntesis de hemo y la síntesis de globina. Finalmente, el grupo hemo protésico, cada uno con cuatro globinas, está vinculado al complejo proteico hemoglobina que contiene hierro. Las alteraciones tanto en la síntesis de hemo como en la de globina pueden provocar graves problemas de salud.
¿Qué es la síntesis de hemoglobina?

Para comprender la síntesis de hemoglobina, primero es necesario conocer la estructura de la hemoglobina. La hemoglobina es un complejo proteico que contiene hierro, que consta de cuatro subunidades de globina, cada una con un grupo hemo protésico.
En la hemoglobina humana adulta hay dos alfa globinas idénticas, así como dos beta globinas idénticas como subunidades. Cada una de estas subunidades está unida a un grupo hemo protésico, que consiste en un complejo de porfirina hierro (II). Por tanto, un complejo de hemoglobina contiene cuatro grupos hemo.
Dependiendo del entorno químico, cada grupo hemo puede unir una molécula de oxígeno al ion ferroso de una manera compleja. Dependiendo de cuántos grupos hemo estén cargados de oxígeno, se habla de oxihemoglobina (alto contenido de oxígeno) o desoxihemoglobina (bajo contenido de oxígeno).
El ion ferroso se encuentra en el medio del anillo de porfirina. En el lateral hay un enlace complejo al residuo de histidina de la globina. Por otro lado, dependiendo del estado energético del ion de hierro, una molécula de oxígeno puede unirse en un complejo. El estado energético está influenciado por condiciones físicas y químicas externas debido a cambios en la conformación de la globina.
Función y tarea
El último paso en la síntesis de hemoglobina consiste en ensamblar el grupo hemo protésico con las cuatro unidades de globina para formar un complejo proteico que contiene hierro. Los componentes individuales están formados por vías biosintéticas independientes.
Los materiales de partida para el anillo de porfirina del grupo hemo son los aminoácidos glicina y succinil-CoA. La succinil-CoA está compuesta por coenzima A y ácido succínico. El ácido succínico es un producto intermedio en la descomposición de los cuerpos cetónicos ricos en energía como parte del metabolismo energético. Con la ayuda de la enzima ácido delta-aminolevulínico sintasa, el ácido delta-aminolevulínico se sintetiza a partir de succinil-CoA y glicina. Dos moléculas de ácido delta-aminolevulínico se condensan con la eliminación de una molécula de agua para formar el derivado de pirrol porfobilinógeno. Con la eliminación del amoniaco y con la ayuda de la enzima uroporfirinógeno-I sintetasa, cuatro moléculas de porfobiliógeno reaccionan para formar hidroximetilbilano. Este se transforma en uroporfirinógeno III con formación de anillos.
La protoporfirina se produce mediante descarboxilación enzimática y deshidratación en las mitocondrias. Con la enzima ferroquelatasa, se incorpora un ion hierro (II) a esta molécula con la formación de hemo. En el citosol de la célula, el hemo está vinculado con la proteína globina para formar el complejo proteico hemoglobina que contiene hierro.
La síntesis de las globinas individuales tiene lugar mediante la biosíntesis de proteínas normal. Como ya se mencionó, el complejo de hemoglobina adulta contiene dos subunidades idénticas de globinas alfa y beta. Debido a su estructura compleja, la hemoglobina terminada ha desarrollado la capacidad de transportar oxígeno y suministrarlo a todas las células del organismo.
Sin embargo, la unión del hierro central al oxígeno no es muy estrecha y puede verse influenciada muy fácilmente por factores químicos y físicos externos. Esto permite que la hemoglobina absorba y libere oxígeno rápidamente. El contenido de oxígeno de la hemoglobina depende, entre otras cosas, de los factores pH, dióxido de carbono u oxígeno, presión parcial o temperatura. Estas variables influyentes cambian, por ejemplo, la conformidad de las globinas, de modo que el enlace de oxígeno puede fortalecerse o debilitarse por ligeros cambios en las condiciones energéticas y estéricas.
Con un valor de pH bajo y una presión parcial de dióxido de carbono alta, el enlace de oxígeno al ión hierro (II) se debilita y, por lo tanto, se favorece la liberación de oxígeno. Exactamente en estas condiciones se produce un recambio metabólico más fuerte, que también tiene una mayor demanda de oxígeno. Por lo tanto, el sistema de transporte de oxígeno se coordina de manera óptima con las necesidades físicas a través de la función de hemoglobina.
Enfermedades y dolencias
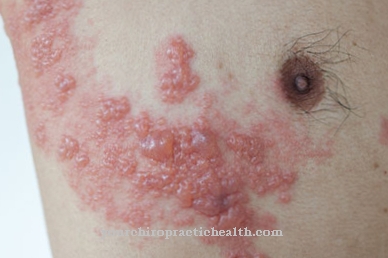
Las alteraciones en la síntesis de hemoglobina pueden provocar diversas enfermedades. Hay una serie de enfermedades genéticas que se basan en la alteración de la síntesis de hemo. En el proceso, los precursores del hemo se acumulan en el cuerpo, lo que, entre otras cosas, conduce a una sensibilidad extrema a la luz. En estas llamadas porfirias, las porfirinas se almacenan en los vasos sanguíneos o incluso en el hígado. Cuando se exponen a la luz, algunas formas de porfiria almacenan más energía de radiación. Cuando se libera la energía, se crean radicales de oxígeno que atacan y destruyen el tejido expuesto. Esto provoca picazón intensa y dolor ardiente.
Hay siete formas de pórfido. La construcción del hemo es un proceso de ocho pasos en el que participan siete enzimas. Si una enzima solo funciona de manera inadecuada, el precursor respectivo se almacena en este punto de la síntesis de hemo. Según los síntomas, las porfirias se dividen en dos grupos principales. Las llamadas porfirias cutáneas se caracterizan por la dolorosa sensibilidad de la piel a la luz. En las porfirias hepáticas predomina la afectación hepática con dolor abdominal intenso, náuseas y vómitos. En muchos casos, sin embargo, existe una superposición entre los dos complejos de síntomas.
Las porfirias a menudo muestran un curso intermitente con ataques agudos. Dependiendo del tipo de porfiria, estas se manifiestan en reacciones cutáneas repentinas y dolorosas, dolor abdominal tipo cólico, náuseas / vómitos, coloración roja de la orina, convulsiones, déficits neurológicos o incluso psicosis.
Otros trastornos de la síntesis de hemoglobina se relacionan con la síntesis defectuosa de moléculas de globina a través de mutaciones en los genes correspondientes. Algunos ejemplos son la llamada anemia falciforme o talasemia. En la anemia de células falciformes, la proteína de la subunidad de la beta globina está modificada genéticamente. En la posición seis de esta proteína, el aminoácido ácido glutámico ha sido reemplazado por valina. Si hay falta de oxígeno, la hemoglobina en cuestión adquiere forma de hoz, se aglutina y obstruye los pequeños vasos sanguíneos. Esto da como resultado trastornos circulatorios potencialmente mortales. Las talasemias son un grupo de diferentes malformaciones de la hemoglobina que conducen a una formación reducida de la cadena de globina de alfa o beta globina.La anemia severa es el síntoma más importante.





.jpg)
.jpg)
.jpg)


.jpg)


.jpg)