Fibronectina es una glucoproteína y juega un papel importante en mantener juntas las células del cuerpo o en la coagulación de la sangre. Asume muchas funciones diferentes en el organismo, que están relacionadas con su capacidad para desarrollar fuerzas adhesivas. Los errores estructurales en la estructura de la fibronectina pueden provocar una debilidad severa del tejido conectivo.
¿Qué es la fibronectina?
La fibronectina es una glucoproteína con un peso molecular de 440 kDa (kilodaltons) que se utiliza para desarrollar fuerzas adhesivas entre las células, entre las células corporales y varios sustratos, entre las células corporales y la matriz intercelular y entre las plaquetas sanguíneas durante la coagulación sanguínea. Por tanto, favorece la cicatrización de heridas, la embriogénesis, la hemostasia, la adhesión celular durante la migración celular o la unión de antígenos a los fagocitos.
La fibronectina primaria contiene 2355 aminoácidos y forma 15 isoformas. Ocurre tanto en el área extracelular como dentro de las células del cuerpo. Fuera de las células es una proteína insoluble, dentro del plasma celular es una proteína soluble. Todas las formas de fibronectina están codificadas por el mismo gen FN1. La fibronectina soluble contiene dos cadenas de proteínas isoméricas que están unidas por un puente disulfuro. En el caso de la fibronectina insoluble, estas moléculas se conectan de nuevo entre sí mediante puentes disulfuro para formar una estructura similar a una fibrilla.
Anatomía y estructura
En su estructura básica, la fibronectina es un heterodímero formado por dos cadenas de proteínas en forma de varilla, unidas por un puente disulfuro. Las cadenas de proteínas isoméricas son expresadas por el mismo gen, el gen FN1. La secuencia de bases diferente resulta del corte y empalme alternativo de este gen. Cada gen contiene exones e intrones. Los exones son secciones que se traducen en la estructura de la proteína. Por el contrario, los intrones son segmentos de genes inactivos. Con el empalme alternativo, la secuencia de los pares de bases sigue siendo la misma, pero los exones y los intrones se encuentran en diferentes segmentos de genes. Al traducir la información genética, los exones legibles se fusionan y los intrones se cortan. Esta traducción alternativa de la misma información genética permite la formación de varias cadenas de proteínas isoméricas a partir del mismo gen.
La fibronectina, formada por dos cadenas de proteínas isoméricas, es soluble, se forma en el hígado y entra al plasma sanguíneo. Allí es responsable de la coagulación de la sangre como parte de la cicatrización de heridas y la regeneración de tejidos. La fibronectina insoluble se produce en los macrófagos, células endoteliales o fibroblastos. Contiene la misma estructura básica. Aquí, sin embargo, las moléculas de fibronectina individuales están conectadas a su vez entre sí mediante puentes disulfuro para formar estructuras proteicas fibrilares que mantienen unidas las células.
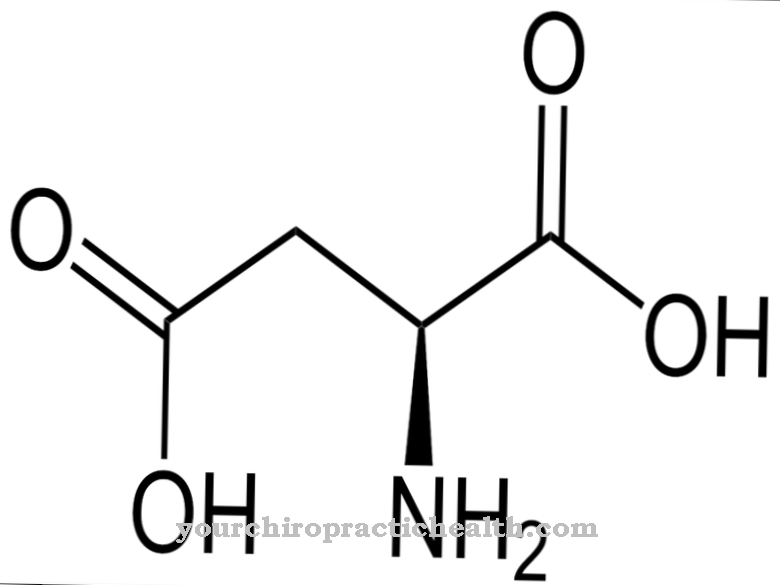
La capacidad de desarrollar fuerzas adhesivas se debe a la secuencia de aminoácidos arginina - glicina - aspartato que se produce con frecuencia. Esto conduce a la adhesión de fibronectina a las denominadas integrinas (receptores de adhesión en la superficie de las células). Las cadenas de proteínas de la fibronectina están formadas por muchos dominios que contienen de 40 a 90 aminoácidos. Debido a la homología de los dominios, las cadenas polipeptídicas de fibronectina se dividen en los tres tipos estructurales I, II y III.
Función y tareas
La fibronectina generalmente sirve para mantener juntas ciertas unidades estructurales. Estos incluyen las células, la matriz extracelular, ciertos sustratos o incluso las plaquetas sanguíneas. La fibronectina solía llamarse Pegamento celular designado. Asegura que las células de los tejidos permanezcan juntas y no se separen.
También juega un papel importante en la migración celular. Incluso el acoplamiento de macrófagos con antígenos está mediado por fibronectina. Además, la fibronectina controla muchos procesos de embriogénesis y diferenciación celular.
Sin embargo, la fibronectina a menudo se reduce en tumores malignos. Esto permite que el tumor crezca en el tejido y forme metástasis al dividir las células tumorales.
La fibronectina soluble en el plasma sanguíneo permite que se formen coágulos de sangre para cerrar las heridas sangrantes. Las plaquetas sanguíneas individuales se unen mediante la formación de fibrina. Como opsonina, la fibronectina se une a la superficie de los macrófagos como receptores. Con la ayuda de estos receptores, los macrófagos pueden unirse e incorporar ciertas partículas que causan enfermedades. En el espacio extracelular, la fibronectina insoluble es responsable de la formación de una matriz que fija las células.
Enfermedades
La deficiencia o las anomalías estructurales de la fibronectina suelen tener efectos graves sobre la salud. Como resultado del crecimiento del cáncer dentro del tumor, la concentración de fibronectina desciende. La estructura celular del tumor se afloja y las células se separan. Esto conduce a metástasis frecuentes debido a la separación de las células tumorales y su migración a través del sistema linfático o del plasma sanguíneo a otras partes del cuerpo. Además, debido a la falta de fibronectina, las células cancerosas pueden crecer en el tejido vecino más rápidamente y así desplazarlo.
Además, existen enfermedades hereditarias que conducen a un defecto en el tejido conectivo. Un ejemplo es el síndrome de Ehlers-Danlos. El síndrome de Ehlers-Danlos no es una enfermedad uniforme, sino que representa un complejo de defectos del tejido conectivo. El tipo X es causado por la falta de fibronectina o la falta de ella. Es una mutación en el gen FN1. Esto conduce a una drástica debilidad del tejido conectivo. La afección se hereda como un rasgo autosómico recesivo. Se manifiesta en piel muy flácida y sobremovilidad de las articulaciones. A pesar de las grandes diferencias en la causa del tejido conectivo débil, los síntomas de las enfermedades individuales de este complejo son similares. Según el dermatólogo danés Edvard Ehlers y el dermatólogo francés Henri-Alexandre Danlos, los síntomas cardinales del síndrome de Ehlers-Danlos son la severa sobreestirabilidad y rasgado de la piel.
Por último, una determinada mutación en el gen FN1 también puede provocar glomerulopatía (enfermedades de los corpúsculos renales). Esta es una enfermedad renal grave que a menudo requiere tratamiento de diálisis.







.jpg)

.jpg)