los Enteropeptidasa es una enzima de la mucosa duodenal cuya función es activar las enzimas pancreáticas. Se encuentra al comienzo de toda una cascada de activación de enzimas digestivas. La disfunción de la enteropeptidasa da lugar a una mala digestión y mala absorción de los alimentos en el intestino delgado.
¿Qué es una enteropeptidasa?
La enteropeptidasa es una enzima de la mucosa duodenal, que activa las enzimas digestivas del páncreas al activar el tripsinógeno a tripsina.
La enteropeptidasa se secreta en el borde en cepillo de la mucosa duodenal. Específicamente, las glándulas de liebekühn son responsables de la secreción. Las glándulas de liebekühn son depresiones tubulares en el epitelio del intestino delgado y grueso. En el intestino delgado, se encuentran entre las vellosidades del intestino delgado. Las glándulas, también conocidas como criptas de Lieberkühn, secretan una gran cantidad de enzimas además de la enteropeptidasa. La secreción de enteropeptidasa se estimula cuando el quimo, que ha sido digerido previamente en el estómago, ingresa al duodeno. La enzima sola no afecta los componentes de los alimentos.
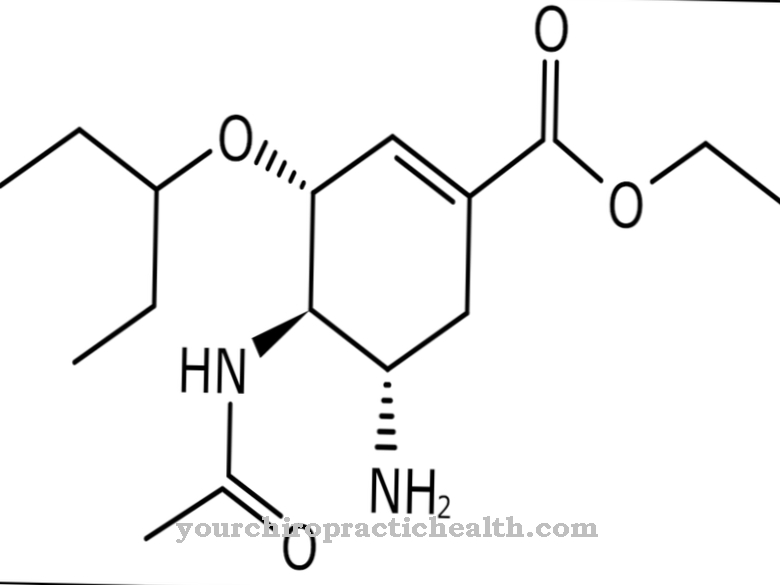
Solo la activación de la enzima tripsina pone en movimiento toda la cascada de activación de las enzimas digestivas. La enteropeptidasa, como la tripsina y otras proteasas del páncreas, es una serina proteasa. El centro activo contiene la tríada catalítica de ácido aspártico, histidina y serina. Como endopeptidasa, la enteropeptidasa solo escinde las proteínas en ciertos puntos característicos con ciertos motivos de reconocimiento en la secuencia de aminoácidos. La enzima siempre se escinde en el motivo de reconocimiento Asp-Asp-Asp-Asp-Lys. Con el tripsinógeno, el hexapéptido Val- (Asp) 4-Lys se escinde y se forma tripsina.
Función, efecto y tareas
La función de la enteropeptidasa es activar las enzimas digestivas en el páncreas. Solo inicia el primer paso de activación con la conversión de tripsinógeno en tripsina.
La tripsina es a su vez una serina proteasa que escinde proteínas basándose en el mismo motivo de reconocimiento característico. Ahora continúa la activación del propio tripsinógeno. Al mismo tiempo, activa otras enzimas pancreáticas a partir de sus respectivos precursores como quimotripsinógeno, pro-elastasa, pro-carboxipeptidasa, pro-fosfolipasa y proenteropeptidasa. La enteropeptidasa también se encuentra inicialmente en la proforma inactiva. Cuando el quimo ingresa al duodeno, no solo se secreta proenteropeptidasa sino también duodenasa, que activa la proforma de enteropeptidasa. Después del inicio de la cascada de activación, la tripsina se hace cargo de la activación de todas las enzimas pancreáticas, incluidas la proenteropeptidasa y el tripsinógeno.
La activación de la proenteropeptidasa a enteropeptidasa se produce de forma incluso más eficaz mediante la acción de la tripsina que a través de la duodenasa. La presencia primaria de las enzimas digestivas en su forma inactiva es extremadamente importante. La acción de las proteasas en particular es inespecífica. Todas las proteínas que contienen el motivo de reconocimiento característico dentro de la molécula se escinden hidrolíticamente. Si las enzimas fueran catalíticamente activas de inmediato, las propias proteínas del cuerpo ya serían digeridas en el páncreas y el conducto pancreático. Como resultado, el páncreas se disolvería. La activación solo tiene lugar en el duodeno fuera de las glándulas exocrinas.
Las enzimas pueden comenzar aquí a descomponer los componentes de los alimentos sin atacar los propios tejidos del cuerpo. Para evitar que las enzimas se activen prematuramente, un inhibidor de tripsina adicional actúa en el conducto del páncreas. Sin embargo, la tripsina desempeña el papel clave de la cascada digestiva. Una vez que se activa esta enzima, no se puede detener la activación de todas las enzimas digestivas, incluida la enteropeptidasa.
Educación, ocurrencia, propiedades y valores óptimos
Como todas las serina proteasas, la enteropeptidasa también tiene un efecto no específico y escinde las proteínas utilizando un motivo de reconocimiento característico. La enteropeptidasa consta de una cadena ligera y una pesada que están unidas por puentes disulfuro. El dominio de serina proteasa se encuentra en la cadena ligera.
La cadena pesada tiene una masa molecular de 82 a 140 kilodaltons, siendo la masa molecular de la cadena ligera de 35 a 62 kilodaltons. La estructura de la cadena ligera de la enteropeptidasa es similar a la de otras serina proteasas, tripsina y quimotripsina. La cadena pesada está unida a la membrana e influye en la especificidad de la enzima. Se encontró que la cadena ligera aislada tiene un efecto similar contra el motivo de reconocimiento característico - (Asp) 4-Lys-, pero un efecto significativamente menor contra el tripsinógeno.
Enfermedades y trastornos
La enteropeptidasa humana está codificada por el gen ENTK en el cromosoma 21. Una mutación de este gen puede provocar enfermedades graves en los niños afectados.
La enzima ya no puede activar las otras enzimas digestivas. Los componentes de los alimentos ya no se descomponen y, por lo tanto, ya no pueden ser absorbidos por el intestino delgado. Es principalmente una cuestión de mala digestión (descomposición insuficiente), lo que conduce a una mala absorción de los componentes de los alimentos. El cuerpo ya no recibe suficientes nutrientes. Se produce retraso del crecimiento, retraso en el crecimiento y síntomas típicos de deficiencia de proteínas con el desarrollo de edema. Al mismo tiempo, además de las proteínas, los carbohidratos y las grasas se absorben mal. Dado que los componentes de los alimentos no digeridos llegan al intestino grueso y se degradan allí por fermentación y bacterias putrefactas, también se producen flatulencias, diarrea y dolor abdominal.
Hasta ahora, se han descrito 15 casos de deficiencia congénita de enteropeptidasa en todo el mundo. Sin embargo, los síntomas de la afección son mucho más comunes. No siempre es necesario que exista una deficiencia de enteropeptidasa. Dado que la tripsina juega un papel clave en la activación de las enzimas digestivas, un defecto o deficiencia en la tripsina también conduce a síntomas similares. El tratamiento de estas enfermedades es el mismo en ambos casos. Las enzimas se administran en forma activada. Ciertamente, hay muchos más casos no diagnosticados de deficiencia de enteropeptidasa.
Si el diagnóstico es seguro, también se podría sustituir por enteropeptidasa. La deficiencia de enteropeptidasa también se desencadena de forma secundaria por enfermedades intestinales graves.Enfermedades como la celiaquía, el acortamiento del intestino delgado, la deficiencia de lactasa u otras deben aclararse en el diagnóstico diferencial.



.jpg)
.jpg)
.jpg)




.jpg)
.jpg)



.jpg)