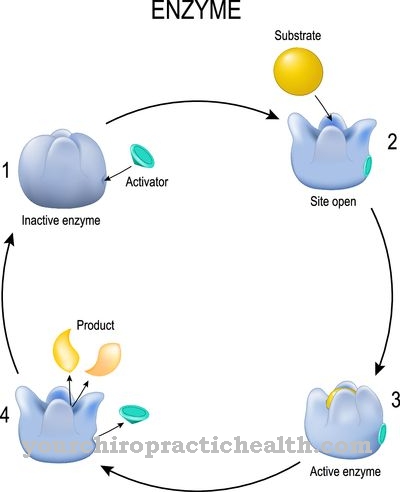
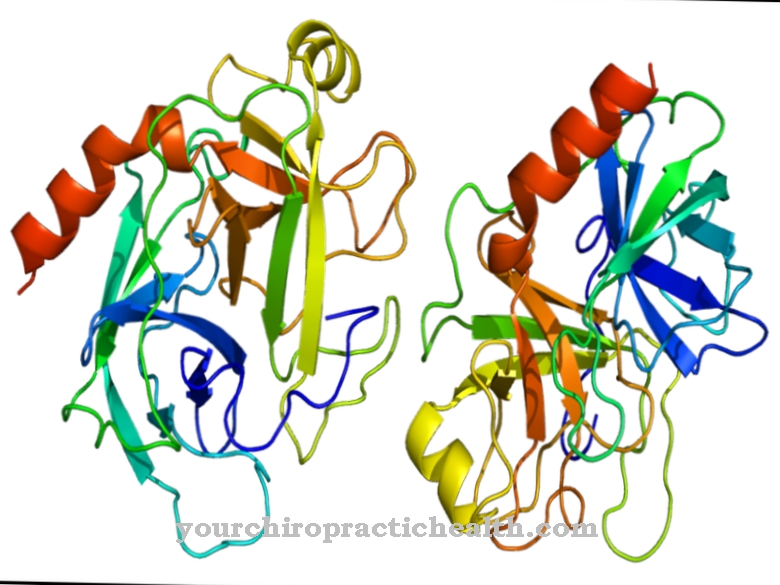
los Aldehído oxidasa es una enzima que descompone los aldehídos en los vertebrados. Se puede encontrar en diferentes tejidos de mamíferos y humanos. La función exacta de la aldehído oxidasa aún no se conoce.
¿Qué es la aldehído oxidasa?
La aldehído oxidasa (AOX1) ayuda con la descomposición enzimática de los aldehídos en el cuerpo. Sin embargo, se encontró que también descompone la nicotina en cotinina. Un átomo de oxígeno se incorpora a la nicotina libre de oxígeno para formar una estructura de aldehído.
Por este hecho, la aldehído oxidasa también es importante para el metabolismo del triptófano y al mismo tiempo para la biotransformación. Se encuentra principalmente en el citosol de las células del hígado, páncreas, pulmones, músculos esqueléticos o células grasas. El cofactor molibdeno es muy importante para la actividad de la enzima. Solo hay un gen AOX en el ADN humano que puede codificar una enzima funcional. Varios genes AOX están activos en otros vertebrados. La aldehído oxidasa es muy similar y está relacionada con la enzima xantina deshidrogenasa.
Ambas enzimas pueden convertir la hipoxantina en xantina al absorber un átomo de oxígeno y una molécula de agua. Sin embargo, la conversión de xantina en ácido úrico solo tiene lugar a través de la xantina hidrogenasa (xantina oxidasa). La aldehído oxidasa consta de 1338 aminoácidos. Molibdopterina, FAD y 2 (2Fe2S) sirven como cofactores de su eficacia. La reacción ya caracterizada por el nombre caracteriza la conversión de aldehídos con la adición de oxígeno y agua a ácidos carboxílicos y peróxido de hidrógeno.
Función, efecto y tareas
La enzima aldehído oxidasa cataliza varias reacciones. En su mayor parte, es responsable de la conversión de aldehídos en ácidos carboxílicos con la adición de oxígeno y agua. En general, la aldehído oxidasa media la adición de un átomo de oxígeno a un sustrato.
Entre otras cosas, también cataliza la conversión de nicotina en conitina. Por tanto, también juega un papel importante en la biotransformación y el metabolismo del triptófano. El molibdeno siempre es necesario como cofactor en estas reacciones. Como parte de la biotransformación, convierte los xenobióticos con grupos aldehído en los correspondientes ácidos carboxílicos en la reacción de fase I. En la reacción de fase II, el ácido glucurónico se une a los grupos carboxilo para aumentar la solubilidad en agua con el fin de eliminar la molécula extraña del cuerpo.
Estructural y químicamente, la aldehído oxidasa está estrechamente relacionada con la enzima homóloga xantina hidrogenasa (xantina oxidasa). Sin embargo, no se sabe por qué la conversión de xantina en ácido úrico con la adición de oxígeno y agua es catalizada únicamente por la xantina oxidasa. La conversión de hipoxantina en xantina todavía es catalizada por ambas enzimas. Además, la aldehído oxidasa también es responsable de la adipogénesis (reproducción de las células grasas).
Estimula la secreción de la hormona tisular adiponectina. La adiponectina, a su vez, aumenta la eficacia de la insulina. En los hepatocitos, la adiponectina a su vez inhibe la liberación de aldehído oxidasa. Una deficiencia de aldehído oxidasa (AOX1) también inhibe la exportación de lípidos de las células. La función exacta de la aldehído oxidasa aún no se comprende completamente.
Educación, ocurrencia, propiedades y valores óptimos
La aldehído oxidasa se encuentra principalmente en el citoplasma de las células hepáticas. Sin embargo, también se encuentra en las células grasas, el tejido pulmonar, los músculos esqueléticos y el páncreas. Solía confundirse con la xantina oxidasa homóloga.
Ambas enzimas tienen una estructura similar. Sin embargo, a veces catalizan diferentes reacciones. Ambas enzimas necesitan los mismos cofactores para su función. Estos son molibdopterina, FAD y 2 (2Fe2S). Sin embargo, la aldehído oxidasa no solo degrada los aldehídos, sino que también es responsable de la oxidación de compuestos N-heterocíclicos como la nicotina a cotinina.
Enfermedades y trastornos
Junto con la xantina deshidrogenasa (xantina oxidasa) y la sulfito oxidasa, la aldehído oxidasa depende del cofactor molibdeno. El molibdeno está integrado en una molibdopterina como un átomo complejo y forma el cofactor de molibdeno. En el caso de una deficiencia de molibdeno, estas tres enzimas funcionan mal.
La xantina deshidrogenasa cataliza la descomposición de la xantina en ácido úrico. La enzima aldehído oxidasa sólo participa parcialmente en este proceso, por ejemplo, cuando la hipoxantina se descompone en xantina. Aquí incluso compite con la xantina oxidasa. Por tanto, no hay deficiencia aislada de aldehído oxidasa. Sin embargo, la aldehído oxidasa favorece la degradación de las catecolaminas. La sulfito oxidasa es responsable de la descomposición de los aminoácidos que contienen azufre como la cisteína, taurina o metionina. Si esta enzima es deficiente, el sulfito ya no se convierte en sulfato. Debido al cofactor molibdeno, las tres enzimas suelen tener una deficiencia común.
Por supuesto, son posibles defectos aislados debidos a mutaciones para cada una de estas enzimas. Sin embargo, hasta el momento no se ha descrito ningún cuadro clínico con una deficiencia específica de aldehído oxidasa. Una deficiencia de molibdeno inducida por una dieta desequilibrada es muy rara. Sin embargo, esto puede suceder con la nutrición parenteral baja en molibdeno durante más de seis meses. En tales casos, son frecuentes la taquipnea, taquicardia, dolor de cabeza intenso, náuseas, vómitos, obstrucción facial central o coma. Además, existen intolerancias a ciertos aminoácidos. Las concentraciones elevadas de sulfito se encuentran en la orina, mientras que los valores disminuidos de ácido úrico se encuentran en la sangre.
Si la deficiencia de molibdeno persiste, puede provocar problemas con la degradación de aminoácidos que contienen azufre, alergias a los sulfitos, caída del cabello, niveles bajos de ácido úrico en sangre y problemas de fertilidad. La mayoría de los síntomas, sin embargo, se deben a la deficiencia de sulfito oxidasa y xantina deshidrogenasa. La taquicardia probablemente se deba a niveles elevados de adrenalina o noradrenalina (catecolaminas), ya que su degradación se retrasa por la falta de aldehído oxidasa. Una deficiencia de molibdeno puede ser causada por una dieta extremadamente baja en molibdeno y por enfermedades inflamatorias del intestino como la enfermedad de Crohn con mala absorción de alimentos.
Una deficiencia hereditaria de cofactor de molibdeno debido a una síntesis alterada de molibdopterina es fatal si las tres enzimas fallan sin tratamiento.

.jpg)




.jpg)



.jpg)