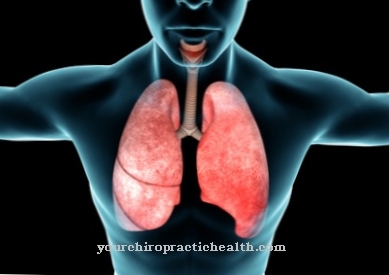
Uno de los elementos más comunes en la tierra es el oxígeno. Aproximadamente una quinta parte del volumen de este elemento químico está presente en el aire, aunque es incoloro, insípido e inodoro. También se encuentra con la misma frecuencia en el agua y en la corteza terrestre. La mayoría de los seres vivos y las células vivas necesitan oxígeno para respirar.
Que es el oxigeno
En la tabla periódica, el oxígeno se indica con el símbolo "O" y tiene el número atómico "8". La mayoría de las veces, se presenta en compuestos y como moléculas de dos y tres átomos. Este último también se conoce como "ozono".
Las rocas y los minerales a menudo contienen oxígeno, como B. cuarzo, mármol o piedra caliza. Los átomos de oxígeno libres e individuales, por otro lado, solo son posibles en forma estable en condiciones extremas. Ese es el caso del vacío del espacio. El oxígeno se puede separar del aire por destilación y luego, cuando se licua, adquiere un color azulado. Tales condiciones se utilizan, p. Ej. B. en el refinamiento de metales, la extracción de productos químicos o como una aplicación médica de soporte vital.
El oxígeno es siempre gaseoso en condiciones normales y, en combinación con otros elementos, participa en muchos procesos de combustión. Fue descubierto e investigado en 1772 por el químico y farmacéutico Carl Wilhelm Scheéle.
Este oxígeno aislado como gas, un proceso que era similar al proceso de pasteurización, y de esta manera descubrió otros elementos también, p. B. nitrógeno. Sin embargo, como no publicó su trabajo sobre el mismo hasta unos años después, se le presentó el químico Josep Priestley, quien, independientemente de él, hizo el mismo descubrimiento, incluyendo qué efectos tenía el oxígeno en los procesos de combustión, aunque el propio proceso en sí todavía estaba allí. no fue descifrado.
Anteriormente, el fuego se veía de manera más metafísica, como uno de los cuatro elementos que componían el ser. Además del fuego, había tierra, aire y agua. En el siglo XVII, el calor se combinó luego con el fuego, y cuando se descubrió en el siglo XVIII, la sustancia se convirtió en un elemento. Pero fue solo a través del erudito privado Antoine Laurent de Lavoisier que fue posible interpretar correctamente la combustión y la respiración. Realizó experimentos con oxígeno puro y determinó la composición del aire.
Función, efecto y tareas
En la atmósfera, el oxígeno siempre se encuentra en forma gaseosa y se disuelve en agua. El elemento es muy reactivo y lo producen principalmente las plantas a través de la fotosíntesis y se consume nuevamente a través de la respiración y otros procesos de combustión. Las algas verdiazules y las cianobacterias también intervienen en estos procesos, que comenzaron hace más de tres mil millones de años para almacenar la luz solar y utilizarla para la síntesis de compuestos orgánicos. El oxígeno era y, por tanto, es un producto de desecho muy eficaz.
Los seres humanos, las plantas y las bacterias necesitan oxígeno para poder vivir y generar energía de esta forma. El procesamiento tiene lugar en las mitocondrias, por lo que el oxígeno en la cadena respiratoria se convierte en agua nuevamente. A su vez, las enzimas descomponen las sustancias del organismo mediante la oxigenación.
Educación, ocurrencia, propiedades y valores óptimos
Sin embargo, la buena reactividad del oxígeno y sus compuestos también puede conducir a una destrucción más peligrosa de las estructuras celulares. Aunque los seres humanos necesitan oxígeno para respirar, demasiado oxígeno es venenoso y, en grandes cantidades, incluso puede provocar daño pulmonar durante un largo período de tiempo.
El organismo humano funciona con una concentración de oxígeno de alrededor del 21 por ciento en el aire. Los glóbulos rojos transportan oxígeno desde los pulmones a los órganos. Si es demasiado alto, los alvéolos pulmonares se hinchan y las células de la pared de los pulmones se necrosan, los neumocitos se dañan y se depositan masas de proteínas en la pared interna. El resultado es un intercambio de gases muy reducido en la respiración y en el torrente sanguíneo.
Asimismo, una mezcla de gases con un aumento de oxígeno puede dañar el sistema nervioso central y provocar síntomas del sistema nervioso central. Hablamos del efecto Paul Bert, que puede manifestarse en ruidos de oído, mareos, náuseas, vómitos, pero también en condiciones drásticas como cambios de personalidad y confusión mental. Este es un efecto secundario común, especialmente en el buceo, por lo que se debe observar el contenido de oxígeno y la profundidad máxima de buceo.
Enfermedades y trastornos
La mayoría de los organismos tienen enzimas protectoras como la peroxidasa y la catalasa para desintoxicar el oxígeno. La descomposición del oxígeno en el cuerpo crea radicales libres que dañan el ADN mitocondrial y que pueden ser contrarrestados por antioxidantes. Estos se ingieren con la comida y son z. B. Vitaminas C, A y E, minerales y oligoelementos.
Un desequilibrio entre las sustancias reductoras y oxidantes en las células conduce a una interrupción de la función de desintoxicación del propio cuerpo y daña la célula. Esto se conoce como estrés oxidativo, que a su vez conduce a procesos de envejecimiento.
La falta de oxígeno es común en las enfermedades cardíacas y pulmonares. Esto, a su vez, tiene efectos dañinos en las arterias y tejidos de todos los órganos vitales. Aquí, también se debe administrar oxígeno y se debe proporcionar respiración artificial. El oxígeno también sirve para el proceso de curación de heridas en sí. Las heridas pueden infectarse después de una cirugía, en la que influyen la tensión de oxígeno en los tejidos y las células inmunitarias de la sangre, que utilizan radicales libres para combatir las bacterias del cuerpo. En la mayoría de los casos, también se suministra oxígeno después de la anestesia para reducir el riesgo de infección.
Las enfermedades asociadas con la deficiencia crónica de oxígeno requieren oxigenoterapia a largo plazo. Las causas pueden ser un estrechamiento de las vías respiratorias, embolia pulmonar, daño al tejido pulmonar o defectos cardíacos graves.

.jpg)